Hvad holder molekylerne i faste sammen?
Her er de vigtigste typer intermolekylære kræfter:
* van der Waals Forces: Dette er svage, midlertidige kræfter, der opstår som følge af midlertidige udsving i elektronfordeling inden for molekyler. De er til stede mellem alle molekyler, men er især vigtige i ikke -polære molekyler.
* London Dispersion Forces: Dette er den svageste type van der Waals -kræfter og er til stede i alle molekyler.
* dipol-dipol-kræfter: Disse kræfter forekommer mellem polære molekyler, hvor den positive ende af et molekyle tiltrækker den negative ende af en anden.
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der opstår, når et hydrogenatom er bundet til et meget elektronegativt atom, såsom ilt, nitrogen eller fluor. Det er den stærkeste type intermolekylær kraft.
* ioniske kræfter: Disse kræfter forekommer mellem modsat ladede ioner. De er til stede i ioniske forbindelser.
Den specifikke type intermolekylær kraft, der dominerer i et fast stof, afhænger af den type molekyler, der er til stede. For eksempel er vand en fast (is) ved lave temperaturer på grund af stærk brintbinding mellem vandmolekyler.
Nøglepunkter:
* Intermolekylære kræfter er ansvarlige for de fysiske egenskaber ved faste stoffer, såsom deres smeltepunkt, hårdhed og densitet.
* Jo stærkere de intermolekylære kræfter, jo mere tæt holdes molekylerne sammen, og jo højere er det faste stof.
* Generelt er faste stoffer med stærke intermolekylære kræfter mere stive og har højere smeltepunkter end faste stoffer med svage intermolekylære kræfter.
Sidste artikelEr gasvæske og faste partikler den samme vægt?
Næste artikelEr rock opdelt i små stykker en kemisk ændring?
 Varme artikler
Varme artikler
-
 Omdannelse af gas til brændstoffer med bedre legeringerAfbildet, platin-kobber enkeltatom legeringen. Kobber (orange) er ude af stand til at bryde bindinger mellem kulstof (sort) og brint (klart) i metanderivater undtagen ved højere temperaturer, men et e
Omdannelse af gas til brændstoffer med bedre legeringerAfbildet, platin-kobber enkeltatom legeringen. Kobber (orange) er ude af stand til at bryde bindinger mellem kulstof (sort) og brint (klart) i metanderivater undtagen ved højere temperaturer, men et e -
 Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e
Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e -
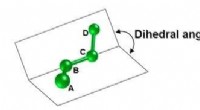 Fujitsu udvikler molekylær simuleringsteknologi til effektivt at skabe nye lægemiddelkandidaterFigur 1:Dihedral vinkel (vinklen dannet af planet skabt af atomer A, B, og C, og flyet skabt af atomer B, C, og D). Kredit:Fujitsu Fujitsu Laboratories annoncerede i dag udviklingen af molekylær
Fujitsu udvikler molekylær simuleringsteknologi til effektivt at skabe nye lægemiddelkandidaterFigur 1:Dihedral vinkel (vinklen dannet af planet skabt af atomer A, B, og C, og flyet skabt af atomer B, C, og D). Kredit:Fujitsu Fujitsu Laboratories annoncerede i dag udviklingen af molekylær -
 Methanthiol, et potentielt nyt råstof i C1 -kemiMiao Yu. Kredit:Eindhoven University of Technology Katalytisk omdannelse af molekyler med ét carbonatom, såsom metan, kuldioxid (CO 2 ), methanol (CH 3 OH) og andre til kemikalier af højere væ
Methanthiol, et potentielt nyt råstof i C1 -kemiMiao Yu. Kredit:Eindhoven University of Technology Katalytisk omdannelse af molekyler med ét carbonatom, såsom metan, kuldioxid (CO 2 ), methanol (CH 3 OH) og andre til kemikalier af højere væ
- Hvad er der inde i Ceres? Nye fund fra gravitationsdata
- Kan Seahawks -fans forårsage et større jordskælv?
- Hvilken scene -mitose er det, når kromosomer forkorter og tykkere den nukleare membran begynder at …
- At skelne mellem Descriptive & Causal Studies
- Hvor lang tid ville det tage at bestige Vesuv?
- Sådan undervises rottælling


