Hvordan dannes salpetersyre (HNO3)?
1. Ostwald -proces:
Dette er den mest almindelige industrielle metode til fremstilling af salpetersyre. Det involverer følgende trin:
* Oxidation af ammoniak: Ammoniak (NH3) oxideres med luft i nærvær af en platinekatalysator ved høj temperatur (850-900 ° C) for at danne nitrogenoxid (NO).
* 4 NH3 (G) + 5 O2 (G) → 4 Nej (G) + 6 H2O (G)
* Yderligere oxidation: Nitrogenoxidet (NO) oxideres yderligere med luft til dannelse af nitrogendioxid (NO2).
* 2 Nej (G) + O2 (G) → 2 NO2 (G)
* Absorption: Kvælstofdioxid (NO2) absorberes i vand til dannelse af salpetersyre (HNO3) og nitrogenoxid (NO).
* 3 NO2 (G) + H2O (L) → 2 HNO3 (AQ) + NO (G)
* genanvendelse: Nitrogenoxidet (NO) genanvendes tilbage til det andet trin for yderligere oxidation.
2. Andre metoder:
* Direkte reaktion af nitrogendioxid med vand: Denne metode er mindre effektiv end Ostwald -processen.
* 3 NO2 (G) + H2O (L) → 2 HNO3 (AQ) + NO (G)
* reaktion af nitrogenoxider med brintperoxid: Denne metode bruges til at producere salpetersyre med høj renhed.
* NO2 (G) + H2O2 (L) → HNO3 (AQ) + H2O (L)
* Laboratoriesyntese: Salpetersyre kan syntetiseres i laboratoriet ved at reagere koncentreret svovlsyre med et nitratsalt, såsom natriumnitrat.
* NANO3 (S) + H2SO4 (L) → NAHSO4 (S) + HNO3 (G)
Uanset den anvendte metode involverer dannelsen af salpetersyre altid oxidation af nitrogen og tilstedeværelsen af vand.
Sidste artikelHvad er ligningen for N2O?
Næste artikelHvorfor er salpetersyre (HNO3) vigtigt?
 Varme artikler
Varme artikler
-
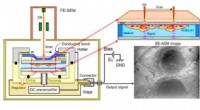 Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret -
 Hvordan protoner bevæger sig gennem en brændselscelleKredit:iStock Brint betragtes som fremtidens energikilde:Det produceres med solenergi og kan bruges til at generere varme og elektricitet i brændselsceller. Det er nu lykkedes for Empa -forskere a
Hvordan protoner bevæger sig gennem en brændselscelleKredit:iStock Brint betragtes som fremtidens energikilde:Det produceres med solenergi og kan bruges til at generere varme og elektricitet i brændselsceller. Det er nu lykkedes for Empa -forskere a -
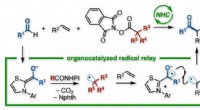 Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupperEt japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller el
Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupperEt japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller el -
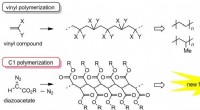 Udvikling af en ny slutfunktionaliseringsteknik i polymersyntesePolymerisation af vinylforbindelse og C1-polymerisation af diazoacetat. Kredit:Ehime University Vinylpolymerisation (polymerisation af vinylforbindelser) er en nyttig metode til fremstilling af sp3
Udvikling af en ny slutfunktionaliseringsteknik i polymersyntesePolymerisation af vinylforbindelse og C1-polymerisation af diazoacetat. Kredit:Ehime University Vinylpolymerisation (polymerisation af vinylforbindelser) er en nyttig metode til fremstilling af sp3
- Krænker evolutionen den anden lov om termodynamik?
- Kan relationer blomstre gennem teknologi alene?
- Open source-system, der sikrer softwareopdateringer, der er uddannet for at beskytte førende cloud-…
- Ramte en asteroide USA?
- Hvorfor klassificeres Euglena som en protoctist og ikke et dyr eller en plante?
- Hvor mange ikke-bindende elektroner er der i et vandmolekyle?


