Hvad får gas til at ændre en væske?
Sådan fungerer det:
* varmeenergi: Når en flydende absorberer nok varmeenergi, begynder molekylerne der inde i den hurtigere og hurtigere.
* overvinde intermolekylære kræfter: Molekylerne i en væske holdes sammen af svage tiltrækningskræfter kaldet intermolekylære kræfter. Når molekylerne bevæger sig hurtigere, overvinder de disse kræfter og slipper fri fra den flydende tilstand.
* udvidelse: De nu frie molekyler spreder sig og fylder den tilgængelige plads og bliver en gas.
Der er to hovedtyper af fordampning:
1. Fordampning: Dette forekommer ved overfladen af en væske, når nogle molekyler har nok energi til at flygte i luften. Tænk på en vandpyt, der tørrer op i solen.
2. kogning: Dette sker, når væsken når sit kogepunkt, hvor damptrykket af væsken er lig med det omgivende atmosfæriske tryk. Dette gør det muligt for væsken at blive til gas i hele dens volumen, ikke kun på overfladen. Tænk på vandkogning på komfuret.
Så for at opsummere: varmeenergi får en væske til at skifte til en gas, ikke omvendt.
Sidste artikelEr NAHCO3- NaOH2 plus CO2 afbalanceret?
Næste artikelHvad er opløsningsmidlet i en saltopløsning som saltvand?
 Varme artikler
Varme artikler
-
 Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens
Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens -
 Foto-responsive proteinhydrogeler som middel til kontrolleret frigivelse af stamceller/proteinerMaterialedesign styrket af proteinsekvensrum. Kredit:Institut for Kemisk og Biologisk Teknik, HKUST Hydrogels, kendt for deres biomimetiske egenskaber, er de førende materialer til biomedicinske a
Foto-responsive proteinhydrogeler som middel til kontrolleret frigivelse af stamceller/proteinerMaterialedesign styrket af proteinsekvensrum. Kredit:Institut for Kemisk og Biologisk Teknik, HKUST Hydrogels, kendt for deres biomimetiske egenskaber, er de førende materialer til biomedicinske a -
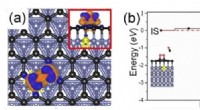 Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå (
Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå ( -
 Undersøgelse giver nye spor til forbedring af kemoterapierStrukturen af proteinet kodet af tnmS3-genet. Kredit:Shen Lab/Scripps Research Omkring halvdelen af alle stoffer, lige fra morfin til penicillin, kommer fra forbindelser, der er fra - eller er
Undersøgelse giver nye spor til forbedring af kemoterapierStrukturen af proteinet kodet af tnmS3-genet. Kredit:Shen Lab/Scripps Research Omkring halvdelen af alle stoffer, lige fra morfin til penicillin, kommer fra forbindelser, der er fra - eller er


