Hvornår er molekylerne tæt sammen i et objekt?
* fast: Molekyler er tæt pakket og holdes i en stiv struktur. De vibrerer på plads, men bevæger sig ikke frit.
* væske: Molekyler er tættere sammen end i en gas, men de kan bevæge sig rundt og glide forbi hinanden. Dette giver væsker deres fluiditet.
* gas: Molekyler er langt fra hinanden og bevæger sig frit og kolliderer med hinanden og væggene i deres beholder.
Kortfattet:
* faste stoffer har de nærmeste molekyler På grund af stærke intermolekylære kræfter og stiv struktur.
* væsker har molekyler tættere sammen end gasser Men ikke så tæt pakket som faste stoffer.
* Gasser har de længste molekyler På grund af svagere intermolekylære kræfter og fri bevægelighed.
Det er vigtigt at huske, at selv i gasser er molekyler stadig teknisk "tæt sammen" i det store skema med ting. De har bare meget mere plads mellem dem sammenlignet med væsker og faste stoffer.
 Varme artikler
Varme artikler
-
 Almindelig herbicidforbindelse kan redde millioner af livUQ -ph.d. -studerende Mario D. Garcia udfører et af de mange eksperimenter, der er involveret i forskningen. Kredit:University of Queensland En kemisk forbindelse, der findes i almindelige herbici
Almindelig herbicidforbindelse kan redde millioner af livUQ -ph.d. -studerende Mario D. Garcia udfører et af de mange eksperimenter, der er involveret i forskningen. Kredit:University of Queensland En kemisk forbindelse, der findes i almindelige herbici -
 Team skaber mikrober for at omdanne affald til nyttige kemikalierForskere gensplejsede bakterier til produktion af itaconsyre, skabe dynamiske kontroller, der adskiller mikrobielle vækst- og produktionsfaser for øget effektivitet og syreudbytte. Kredit:NREL Et
Team skaber mikrober for at omdanne affald til nyttige kemikalierForskere gensplejsede bakterier til produktion af itaconsyre, skabe dynamiske kontroller, der adskiller mikrobielle vækst- og produktionsfaser for øget effektivitet og syreudbytte. Kredit:NREL Et -
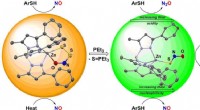 Sporing af nitrogenoxid-signalvejenKredit:Wiley Både nitrogenoxid (NO) og svovlbrinte (H 2 S) fungerer som gasformige signalmolekyler med lignende fysiologiske virkninger. Mange af de kritiske spørgsmål om samspillet mellem disse
Sporing af nitrogenoxid-signalvejenKredit:Wiley Både nitrogenoxid (NO) og svovlbrinte (H 2 S) fungerer som gasformige signalmolekyler med lignende fysiologiske virkninger. Mange af de kritiske spørgsmål om samspillet mellem disse -
 En grænsedans for amyloid-β, der træder ind i demens(a) Et Aβ-peptid, der danner en β-hårnålestruktur ved den hydrofile/hydrofobe grænseflade. (b) Udsigt fra bunden af panelet (a). Kredit:ExCELLS/IMS Alzheimers sygdom er forårsaget af aggregater
En grænsedans for amyloid-β, der træder ind i demens(a) Et Aβ-peptid, der danner en β-hårnålestruktur ved den hydrofile/hydrofobe grænseflade. (b) Udsigt fra bunden af panelet (a). Kredit:ExCELLS/IMS Alzheimers sygdom er forårsaget af aggregater
- Ulemper og fordele ved en HPLC
- Hvilke elementer under farekommunikationsstandarden kræver på hver mærkat med farlige kemikalier?…
- Hvorfor kan fleksibilitet og åben mindedness være ønskelige kvaliteter hos en videnskabsmand?
- ESAs solformørkelsesmaskine, Proba-3
- Forskere siger, at jobkandidater bliver vurderet lavere i virtuelle interviews
- Hvad gør realistiske robotter så uhyggelige?


