Hvad er forskellen mellem gasformig og flydende tilstand af samme stof?
Gasformet tilstand:
* Arrangement: Molekyler er langt fra hinanden og distribueres tilfældigt.
* Bevægelse: Molekyler bevæger sig frit og hurtigt i alle retninger.
* kræfter: Svage intermolekylære kræfter, der giver molekyler mulighed for at bevæge sig uafhængigt.
* Form &volumen: Tager formen og volumenet på dens beholder.
* Kompressibilitet: Meget komprimerbar på grund af store rum mellem molekyler.
* densitet: Lav tæthed på grund af bred afstand mellem molekyler.
flydende tilstand:
* Arrangement: Molekyler er tæt sammen, men kan bevæge sig forbi hinanden.
* Bevægelse: Molekyler bevæger sig tilfældigt, men i en langsommere hastighed end gasser.
* kræfter: Stærkere intermolekylære kræfter end gasser, men svagere end faste stoffer.
* Form &volumen: Tager formen på sin beholder, men har et fast volumen.
* Kompressibilitet: Mindre komprimerbar end gasser på grund af tættere pakning.
* densitet: Højere densitet end gasser på grund af tættere pakning.
Her er en analogi:
* Forestil dig en gruppe mennesker i et stort, åbent felt (gas). De kan bevæge sig frit og uafhængigt.
* Forestil dig nu den samme gruppe mennesker i et overfyldt rum (væske). De er tættere på hinanden og kan bevæge sig rundt, men med mindre frihed.
Kortfattet:
Den største forskel er styrken af intermolekylære kræfter :
* Gasser: Svage kræfter bevæger molekyler sig frit
* væsker: Stærkere kræfter bevæger molekyler sig mindre frit og opretholder et fast volumen.
Husk det:
* Dette er en forenklet forklaring. Der er nuancer og undtagelser.
* Staten for et stof bestemmes af dets temperatur og tryk.
* Nogle stoffer kan eksistere i alle tre tilstande af stof (fast, flydende, gas) afhængigt af forholdene.
 Varme artikler
Varme artikler
-
 Kuldioxid-til-methanol-proces forbedret med katalysatorChunshan Song, venstre, og Xiao Jiang er to Penn State-forskere, der undersøger måder at bruge kuldioxid som råmateriale til at skabe brændstoffer og materialer. Song er direktør for EMS Energy Instit
Kuldioxid-til-methanol-proces forbedret med katalysatorChunshan Song, venstre, og Xiao Jiang er to Penn State-forskere, der undersøger måder at bruge kuldioxid som råmateriale til at skabe brændstoffer og materialer. Song er direktør for EMS Energy Instit -
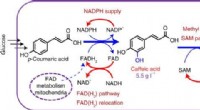 Cofactor engineering driver naturlig produktsynteseGrafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01014-6 I det sidste årti har fremskridt inden for syntetisk biologi banet vejen mod bæredygtig syntese af komplekse
Cofactor engineering driver naturlig produktsynteseGrafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01014-6 I det sidste årti har fremskridt inden for syntetisk biologi banet vejen mod bæredygtig syntese af komplekse -
 Opdagelse af nye lægemidler er en lang og dyr proces:Kemiske forbindelser, som duper screeningsvær…Kredit:Pixabay/CC0 Public Domain Moderne lægemiddelopdagelse er en dyr og kompliceret proces. Hundredvis af videnskabsmænd og mindst et årti er ofte påkrævet for at producere en enkelt medicin. Et
Opdagelse af nye lægemidler er en lang og dyr proces:Kemiske forbindelser, som duper screeningsvær…Kredit:Pixabay/CC0 Public Domain Moderne lægemiddelopdagelse er en dyr og kompliceret proces. Hundredvis af videnskabsmænd og mindst et årti er ofte påkrævet for at producere en enkelt medicin. Et -
 Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno
Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno
- Hvilke planter producerer separate mandlige og kvindelige kegler, som mikrosporer megasporer udvikle…
- Kinesisk snooping -teknologi spreder sig til nationer, der er sårbare over for overgreb
- Drikkevand i flere kinesiske byer indeholder høje niveauer af persistente kemikalier
- Opfører demokratier sig anderledes end ikke-demokratier, når det kommer til udenrigspolitik?
- Vejledning til undervisere om, hvordan de kan tackle protesterne i hele USA og verden
- Hvad er en fejl begået af en videnskabsmand under eksperimentet?


