Hvordan er opløseligheden af gasser i væsker påvirket af temperaturændringer?
1. Kinetisk energi og flugt:
* øget temperatur Midler molekyler i både væske- og gasfaser har højere kinetisk energi.
* Denne øgede energi gør det lettere for gasmolekylerne, der blev opløst i væsken for at overvinde de attraktive kræfter, der holder dem i opløsning og flugt tilbage i gasfasen.
2. Nedsat intermolekylære kræfter:
* Ved højere temperaturer bevæger væskemolekylerne sig hurtigere, og de intermolekylære kræfter mellem dem svækkes.
* Dette gør det sværere for gasmolekylerne at interagere med de flydende molekyler og forblive opløst.
3. Trykvirkninger:
* Temperatur påvirker gasopløselighed indirekte gennem tryk. Når temperaturen øges, øges damptrykket af gassen over væsken også.
* Dette højere damptryk skubber mere af den opløste gas ud af opløsningen.
Eksempler:
* Åbning af en flaske soda: Du vil bemærke, at en varm soda går hurtigt fladt. Dette skyldes, at den øgede temperatur får den opløste kuldioxidgas til at flygte.
* kogende vand: Når du koger vand, udvises de opløste gasser (som ilt og nitrogen) i luften.
Praktiske implikationer:
* fisk og akvatisk liv: Varmere vand holder mindre opløst ilt, hvilket gør det vanskeligt for fisk og andre akvatiske organismer at overleve.
* Klimaændringer: Havopvarmning får opløseligheden af CO2 til at falde, hvilket bidrager til en positiv feedback -loop, der fremskynder klimaændringerne.
* Kemiske reaktioner: Temperatur kan bruges til at kontrollere opløseligheden af gasser i industrielle processer, hvilket påvirker reaktionshastigheder og udbytter.
Key Takeaway: Tænk på det sådan:Varme gør gasmolekylerne "ønsker" at flygte fra væsken, som at prøve at komme ud af et overfyldt, varmt rum.
Sidste artikelHvorfor er kulsyre vigtig?
Næste artikelEr hydrogenperoxid et rent stof eller en blanding?
 Varme artikler
Varme artikler
-
 Et nyt værktøj til kryo-elektronmikroskopiMikroskopisk billede (øverst) og struktur (nederst) af proteinet hæmocyanin (højre) og tobaksmosaikvirus (til venstre) af iDPC-STEM. Nedenfor de tilsvarende 3D-strukturer ved 3,5 og 6,5 Å opløsning. K
Et nyt værktøj til kryo-elektronmikroskopiMikroskopisk billede (øverst) og struktur (nederst) af proteinet hæmocyanin (højre) og tobaksmosaikvirus (til venstre) af iDPC-STEM. Nedenfor de tilsvarende 3D-strukturer ved 3,5 og 6,5 Å opløsning. K -
 Nyt værktøj udviklet til at diagnosticere og overvåge autoimmune lidelserKredit:Daria Sokol/MIPT Forskere fra Prokhorov General Physics Institute ved Det Russiske Videnskabsakademi og Moskva Institut for Fysik og Teknologi har udviklet en ny metode til diagnosticering
Nyt værktøj udviklet til at diagnosticere og overvåge autoimmune lidelserKredit:Daria Sokol/MIPT Forskere fra Prokhorov General Physics Institute ved Det Russiske Videnskabsakademi og Moskva Institut for Fysik og Teknologi har udviklet en ny metode til diagnosticering -
 Biokemikere dykker ned i sundhedsmæssige fordele ved oliven og olivenolieOlivenolie hældes over mad. Kredit:Centers for Disease Control and Prevention. Sundhedsmæssige fordele ved oliven - og tilhørende naturprodukter som olivenolie - er længe blevet anerkendt og udråb
Biokemikere dykker ned i sundhedsmæssige fordele ved oliven og olivenolieOlivenolie hældes over mad. Kredit:Centers for Disease Control and Prevention. Sundhedsmæssige fordele ved oliven - og tilhørende naturprodukter som olivenolie - er længe blevet anerkendt og udråb -
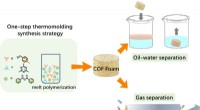 Ved brug af smeltepolymerisation til fremstilling af robuste kovalente organiske rammeskumKonstruer kovalente organiske rammer skumseparatorer ved smeltepolymerisation. Kredit:Science China Press Adsorptionsbaserede (f.eks. gas- eller væskemolekyler) separationsteknologier har vist unik
Ved brug af smeltepolymerisation til fremstilling af robuste kovalente organiske rammeskumKonstruer kovalente organiske rammer skumseparatorer ved smeltepolymerisation. Kredit:Science China Press Adsorptionsbaserede (f.eks. gas- eller væskemolekyler) separationsteknologier har vist unik
- Virkningen af orkaner på Puerto Ricos tørre skove
- Rippelmærker indikerer sandsynligvis, at en klippe dannet?
- Ingeniører udvikler en måde at bestemme, hvordan overfladerne af materialer opfører sig
- At have to job er fantastisk for arbejdsgivere, men familielivet lider
- Hvilke egenskaber ved vand hjælper med at bevæge sig op i rødderne et træ til at blade mod kraft…
- Hvordan påvirker temperaturen, hvor hurtigt salt opløses i vand?


