Hvorfor danner SI ikke dobbeltbinding med ilt?
* størrelse og elektronegativitet: Silicium er større og mindre elektronegativ end kulstof. Dette betyder, at dens valenselektroner er længere væk fra kernen og holdes mindre tæt. Oxygen, der er mindre og mere elektronegativ, trækker elektronerne mod sig selv, hvilket gør det sværere for silicium at dele sine elektroner i en dobbeltbinding.
* π-binding: Dobbeltbindinger involverer dannelsen af en Sigma -binding og en PI -binding. PI-bindingen dannes ved sidelæns overlapning af p-orbitaler. Silicium har en større atomradius, og dens p-orbitaler er mindre effektive til at danne stærke π-bindinger.
* d-orbital deltagelse: Selvom silicium har tomme D-orbitaler, er de ikke let tilgængelige til binding på grund af deres højere energiniveau. Mens nogle teorier antyder d-orbital involvering i π-binding, betragtes det generelt som mindre signifikant sammenlignet med de andre faktorer.
Konsekvenser:
* siliciumdioxid (SiO2): Siliciumdioxid danner en stærk kovalent netværksstruktur med enkeltbindinger mellem silicium og ilt. Denne netværksstruktur giver siliciumdioxid sit høje smeltepunkt og hårdhed.
* siliconer: I stedet for at danne dobbeltbindinger med ilt, danner silicium enkeltbindinger med ilt og også bindinger med organiske grupper. Dette resulterer i dannelsen af siliconer, der bruges i en lang række applikationer på grund af deres unikke egenskaber.
Sammenfattende forhindrer kombinationen af Silicons størrelse, elektronegativitet og vanskeligheden med at danne stabile π-bindinger i at danne dobbeltbindinger med ilt.
 Varme artikler
Varme artikler
-
 Kunstige muskler drevet af glukoseDen kunstige muskel udviklet af forskere ved Linköpings Universitet består af polymermateriale, som forskerne har integreret enzymer i. En opløsning af glucose og oxygen i vand driver polymeraktuatore
Kunstige muskler drevet af glukoseDen kunstige muskel udviklet af forskere ved Linköpings Universitet består af polymermateriale, som forskerne har integreret enzymer i. En opløsning af glucose og oxygen i vand driver polymeraktuatore -
 Forskere præsenterer en ny tilgang til overvågning af ferskvands sundhedMinION er en bærbar enhed, der kan sekvensere genetisk materiale, der er taget fra miljøet - her, fra River Cam i Cambridge, Storbritannien. Kredit:Team PuntSeq (CC BY 4.0) Forskere har brugt verd
Forskere præsenterer en ny tilgang til overvågning af ferskvands sundhedMinION er en bærbar enhed, der kan sekvensere genetisk materiale, der er taget fra miljøet - her, fra River Cam i Cambridge, Storbritannien. Kredit:Team PuntSeq (CC BY 4.0) Forskere har brugt verd -
 Forskere søger at udvikle antiviral membranmaskeUniversity of Kentucky-forsker Dibakar Bhattacharyya har konceptet og midlerne til at udvikle en medicinsk ansigtsmaske, der vil fange og deaktivere COVID-19-virussen ved kontakt. Kredit:University of
Forskere søger at udvikle antiviral membranmaskeUniversity of Kentucky-forsker Dibakar Bhattacharyya har konceptet og midlerne til at udvikle en medicinsk ansigtsmaske, der vil fange og deaktivere COVID-19-virussen ved kontakt. Kredit:University of -
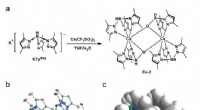 Lys fra sjældne jordarter:Nye muligheder for organiske lysdioderSyntesevej og molekylær struktur af Ce-2 kompleks. Kredit:Science China Press 2,8 eV) gør blå phosphorescerende OLED dårligt stabil. Derfor, de blå lysemitterende materialer, der i øjeblikket anve
Lys fra sjældne jordarter:Nye muligheder for organiske lysdioderSyntesevej og molekylær struktur af Ce-2 kompleks. Kredit:Science China Press 2,8 eV) gør blå phosphorescerende OLED dårligt stabil. Derfor, de blå lysemitterende materialer, der i øjeblikket anve
- Tubuli for at stoppe cellevækst
- Sandt eller falsk er kemisk energi en type potentiale på grund af sammensætningsstoffet?
- Hvorfor er inerte gasser altid stabile?
- Sådan beregnes forholdet mellem to tal
- Instrument på BESSY II viser, hvordan lys aktiverer molybdændisulfidlag til at blive katalysatorer
- Tørretumbler, varmere natteluft gør nogle vestlige naturbrande mere aktive om natten


