Når Cu og Agno3 opvarmes, hvilken farve det giver hvorfor?
reaktionen:
Kobber er mere reaktiv end sølv. Dette betyder, at det kan fortrænge sølv fra dets sammensætning. Reaktionen ser sådan ud:
Cu (s) + 2agno₃ (aq) → Cu (no₃) ₂ (aq) + 2ag (s)
Hvad sker der:
1. forskydning: Kobberatomerne reagerer med sølvnitratopløsningen. Kobberatomer donerer elektroner til sølvioner (AG⁺) i opløsningen, hvilket får sølvionerne til at blive neutrale sølvatomer.
2. Dannelse af sølv: Sølvatomerne udfælder derefter ud af opløsningen som massivt sølv og danner en skinnende, metallisk belægning på kobberet.
3. kobbernitrat: Kobberioner (Cu²⁺) dannet i processen opløses i opløsningen og danner kobbernitrat (Cu (No₃) ₂).
Farveændringen:
Nøglen til farveændringen er dannelsen af fast sølv:
* Oprindeligt: Kobbertråden har sin typiske rødbrune farve.
* Under reaktionen: Sølvbelægningen vises som et skinnende, hvidt/gråt lag på kobberet.
* Løsning: Løsningen, der oprindeligt er farveløs, vil blive blåt som kobbernitrat (Cu (No₃) ₂) former.
Hvorfor skifter farve ?:
Farveændringen skyldes forskellen i den måde, metaller afspejler lys:
* kobber: Kobber reflekterer røde og orange bølgelængder af lys og giver den sin karakteristiske farve.
* sølv: Sølv afspejler alle bølgelængder af lys lige, hvilket får det til at se hvidt/gråt ud.
Kortfattet: Når kobber opvarmes med sølvnitrat, forekommer en kemisk reaktion, der fortrænger sølvioner, der danner fast sølv- og kobbernitrat. Sølvbelægningen på kobbertråden er det, der giver reaktionen dens karakteristiske farveændring.
Sidste artikelHvad er forholdet til 50 1 for kvart gas?
Næste artikelHvad er affarvningsmidlet i syre hurtig plet?
 Varme artikler
Varme artikler
-
 Maskinindlæringsmodel forudsiger fænomenets nøgle til forståelse af materielle egenskaberRobert Rudd, Timofey Frolov og Amit Samanta står foran en simulering af de topologiske atomer i et C2H4 -molekyle som defineret af kvanteteorien om atomer i molekyler (QTAIM) og beregnet ved hjælp af
Maskinindlæringsmodel forudsiger fænomenets nøgle til forståelse af materielle egenskaberRobert Rudd, Timofey Frolov og Amit Samanta står foran en simulering af de topologiske atomer i et C2H4 -molekyle som defineret af kvanteteorien om atomer i molekyler (QTAIM) og beregnet ved hjælp af -
 Kemikere udvikler et nyt Washington Red-farvestof til bio-billeddannelseVisualisering af cellulært svovlbrinte ved hjælp af en Washington Red-baseret fluorescerende sensor. Kredit:WSU Forskere fra Washington State University har skabt et injicerbart farvestof, der bel
Kemikere udvikler et nyt Washington Red-farvestof til bio-billeddannelseVisualisering af cellulært svovlbrinte ved hjælp af en Washington Red-baseret fluorescerende sensor. Kredit:WSU Forskere fra Washington State University har skabt et injicerbart farvestof, der bel -
 Vrikkende og jiggling:Undersøgelse forklarer, hvordan organismer udvikler sig til at leve ved forsk…Et enzyms dans under den biologiske reaktion, det fremmer, afgør, ved hvilken temperatur enzymet fungerer bedst. Kredit:Dr. Marc van der Kamp og Michael Connolly Den geniale fysiker Richard Feynma
Vrikkende og jiggling:Undersøgelse forklarer, hvordan organismer udvikler sig til at leve ved forsk…Et enzyms dans under den biologiske reaktion, det fremmer, afgør, ved hvilken temperatur enzymet fungerer bedst. Kredit:Dr. Marc van der Kamp og Michael Connolly Den geniale fysiker Richard Feynma -
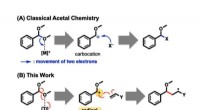 Radikal kemi muliggør ligetil syntese af ethereFigur 1. Aktiveringstilstand for acetaler. (A) Klassisk, acetal C-O-bindinger spaltes på heterolytisk vis. To elektroner, der udgør en C-O-binding, fjernes begge af en sur aktivator ([M]+) for at tilv
Radikal kemi muliggør ligetil syntese af ethereFigur 1. Aktiveringstilstand for acetaler. (A) Klassisk, acetal C-O-bindinger spaltes på heterolytisk vis. To elektroner, der udgør en C-O-binding, fjernes begge af en sur aktivator ([M]+) for at tilv
- <p> I Bronsted-Lowry-formulering af syrer og baser er en syre en forbindelse, der frigiver et proton…
- United slutter sig til Southwest, Amerikansk i ny 737 MAX forsinkelse
- Hvem opdagede Astrolabe?
- Hvad står en stejl bakke alene?
- Hvorfor Kina er seriøs med at blive den globale leder inden for klimaændringer
- Orkanen Maria gav økologer en sjælden chance for at studere, hvordan tropiske tørre skove genopre…


