Når atomer ender med otte eller nul valenselektroner, hvordan er de forskellige fra var før?
* octet regel: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste skal (Valence Shell). Denne konfiguration ligner den af ædle gasser, som er kendt for deres inertitet og manglende reaktivitet.
* nul valenselektroner: Atomer med nul valenselektroner, såsom helium (HE), har allerede en fuld yderste skal, hvilket gør dem iboende stabile. De behøver ikke at vinde eller miste elektroner for at opnå stabilitet.
* stabilitet og reaktivitet: Atomer med otte eller nul valenselektroner betragtes som mere stabile Fordi deres yderste skaller er fulde. Det betyder, at det er mindre sandsynligt, at de deltager i kemiske reaktioner, da de ikke let får eller mister elektroner.
Her er en sammenbrud af ændringerne:
* Elektronegativitet: Atomer, der opnår otte eller nul valenselektroner, har ofte en ændring i elektronegativitet, hvilket er deres evne til at tiltrække elektroner. Dette kan påvirke, hvordan de binder med andre atomer.
* ionisk binding: Atomer, der får eller mister elektroner for at nå otte valenselektroner, danner ofte ioniske bindinger med andre atomer. Dette involverer overførsel af elektroner, hvilket skaber positivt og negativt ladede ioner, der tiltrækker hinanden.
* kovalent binding: Atomer, der deler elektroner for at opnå otte valenselektroner, danner ofte kovalente bindinger . Denne deling af elektroner fører til en mere stabil konfiguration for begge involverede atomer.
Sammenfattende bringer opnåelse af otte eller nul valenselektroner atomer til en tilstand af større stabilitet, hvilket gør dem mindre reaktive og påvirker, hvordan de interagerer med andre atomer.
 Varme artikler
Varme artikler
-
 Nyt effektivt og sikkert svampedræbende middel isoleret fra havsprøjtmikrobiomConidiophores med conidia af de mikroskopiske svampe Aspergillus oryzae under lysmikroskop. Kredit:Yulianna.x / Wikimedia / CC BY-SA 4.0 Ved at finkæmme havet for antimikrobielle stoffer, forskere
Nyt effektivt og sikkert svampedræbende middel isoleret fra havsprøjtmikrobiomConidiophores med conidia af de mikroskopiske svampe Aspergillus oryzae under lysmikroskop. Kredit:Yulianna.x / Wikimedia / CC BY-SA 4.0 Ved at finkæmme havet for antimikrobielle stoffer, forskere -
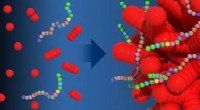 Koralformede nanopartikler bygget af design ved hjælp af konstruerede peptoiderI en ny undersøgelse ledet af PNNL-materialeforsker Chun-Long Chen, sekvensdefinerede peptoider (vist her som kæder af små farverige kugler) muliggjorde den forudsigelige morfologiske udvikling af sfæ
Koralformede nanopartikler bygget af design ved hjælp af konstruerede peptoiderI en ny undersøgelse ledet af PNNL-materialeforsker Chun-Long Chen, sekvensdefinerede peptoider (vist her som kæder af små farverige kugler) muliggjorde den forudsigelige morfologiske udvikling af sfæ -
 At belyse, hvordan asymmetri giver kemiske egenskaberKredit:CC0 Public Domain Du har hørt udtrykket form følger funktion? I materialevidenskab, funktion følger form. Ny forskning af Carnegies Olivier Gagné og samarbejdspartner Frank Hawthorne fra U
At belyse, hvordan asymmetri giver kemiske egenskaberKredit:CC0 Public Domain Du har hørt udtrykket form følger funktion? I materialevidenskab, funktion følger form. Ny forskning af Carnegies Olivier Gagné og samarbejdspartner Frank Hawthorne fra U -
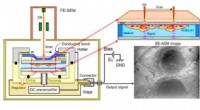 Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
- Hvad er fire typer stof?
- Regler for multiplicering af videnskabelig notation
- Forskere forbedrer metoden til at genbruge og forny brugte katoder fra lithium-ion-batterier
- Rekonstruering af solsystemets originale arkitektur
- Hvor stammede ordsproget o mine stjerner fra?
- Er de fleste sedimentære klipper dannet under vand?


