Hvad er hydrofob forbindelse?
Her er en sammenbrud:
* vand er polært: Det har en positiv ende (brint) og en negativ ende (ilt). Denne polaritet giver vandmolekyler mulighed for at danne stærke brintbindinger med hinanden.
* Hydrofobe forbindelser er ikke -polære: De mangler en betydelig positiv eller negativ ladning. Dette gør det vanskeligt for dem at danne hydrogenbindinger med vandmolekyler.
* frastødning: Da hydrofobe forbindelser ikke kan danne stærke bindinger med vand, har de en tendens til at klynge sig sammen og minimere deres kontakt med vand. Dette skaber en "vandafvisende" effekt.
Eksempler på hydrofobe forbindelser:
* fedt og olier: Disse er sammensat af lange kæder af kulbrinter, som er ikke -polære.
* voks: I lighed med fedt og olier er voksne også ikke -polære.
* Mange typer plast: Plast som polyethylen og polypropylen er lavet af ikke -polære molekyler.
Konsekvenser af hydrofobicitet:
* Dannelse af cellemembraner: Hydrofobe molekyler som phospholipider er essentielle for at danne cellemembranerne, der omgiver alle levende celler. De hydrofobe haler af disse molekyler vender sig indad og skaber en barriere, der adskiller det vandige indre af cellen fra det vandige miljø udenfor.
* opløselighed: Hydrofobe forbindelser opløses ikke let i vand. Dette er grunden til, at olie og vand ikke blandes.
* Betydning i biologiske systemer: Hydrofobicitet spiller en afgørende rolle i mange biologiske processer, herunder proteinfoldning, enzymaktivitet og dannelse af cellestrukturer.
I det væsentlige er hydrofobe forbindelser molekyler, der "frygter" vand, og foretrækker at interagere med andre ikke -polære molekyler i stedet. Deres unikke egenskaber har dybe konsekvenser for en lang række biologiske og kemiske processer.
Sidste artikelEr en vandopløsning af pH 12 farlig for huden?
Næste artikelHvordan udøver gas pres på siden af sin beholder?
 Varme artikler
Varme artikler
-
 Kemiundervisning går onlineKredit:CC0 Public Domain Med gymnasier og universiteter rundt om i verden lukket på grund af COVID-19-pandemien, kemilærere navigerer skiftet til online læring. Der er flere faktorer, der skal ove
Kemiundervisning går onlineKredit:CC0 Public Domain Med gymnasier og universiteter rundt om i verden lukket på grund af COVID-19-pandemien, kemilærere navigerer skiftet til online læring. Der er flere faktorer, der skal ove -
 Gigt, opdagelse af autoimmun sygdom kan føre til nye behandlingerHubert Yin i sit laboratorium på BioFrontiers Institute. Kredit:Glenn Asakawa/CU Boulder Mere end 23,5 millioner amerikanere lider af autoimmune sygdomme som reumatoid arthritis, sklerodermi og lu
Gigt, opdagelse af autoimmun sygdom kan føre til nye behandlingerHubert Yin i sit laboratorium på BioFrontiers Institute. Kredit:Glenn Asakawa/CU Boulder Mere end 23,5 millioner amerikanere lider af autoimmune sygdomme som reumatoid arthritis, sklerodermi og lu -
 Magneter adskiller blandinger af sjældne jordarters metaller bæredygtigtKredit:CC0 Public Domain En ny undersøgelse beskriver en ny tilgang til rensning af sjældne jordarters metaller, afgørende komponenter af teknologi, der kræver miljøskadelige minedriftsprocedurer.
Magneter adskiller blandinger af sjældne jordarters metaller bæredygtigtKredit:CC0 Public Domain En ny undersøgelse beskriver en ny tilgang til rensning af sjældne jordarters metaller, afgørende komponenter af teknologi, der kræver miljøskadelige minedriftsprocedurer. -
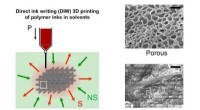 Forskere udvikler en unik metode til fremstilling af 3-D porøse strukturerKoncept for ip3DP - En polymeropløsning printes af en DIW 3D-printer i et ikke-opløsningsmiddel. Den trykte genstand størkner via nedsænkning, og den trykte genstand bibringes porøsitet. Kredit:SUTD
Forskere udvikler en unik metode til fremstilling af 3-D porøse strukturerKoncept for ip3DP - En polymeropløsning printes af en DIW 3D-printer i et ikke-opløsningsmiddel. Den trykte genstand størkner via nedsænkning, og den trykte genstand bibringes porøsitet. Kredit:SUTD
- Hvem kom med celleteori?
- Sammenligning viser værdien af DNA-stregkodning ved udvælgelse af nanopartikler
- Demografiske data hjælper med at forudsige NY oversvømmelsesforsikringskrav
- Dyb kappe kemi overraskelse:Kulstofindhold ikke ensartet
- Gala åbner nedtællingen til 50 -årsdagen for 1. månelanding
- Ude af overensstemmelse:Hvordan sammenstødende politikker giver forfærdelige miljømæssige result…


