Forklar, hvordan de molekylære strukturer af alkaner og alkener adskiller sig?
Her er en sammenbrud:
alkaner:
* struktur: Indeholder kun enkelt obligationer mellem carbonatomer.
* Formel: Generel formel er C n H 2n+2 .
* Eksempel: Methan (CH 4 ), Ethan (C 2 H 6 ), Propan (C 3 H 8 )
alkenes:
* struktur: Indeholder mindst en dobbelt obligation mellem carbonatomer.
* Formel: Generel formel er C n H 2n .
* Eksempel: Ethen (C 2 H 4 ), Propen (C 3 H 6 ), Butene (C 4 H 8 )
Nøgleforskelle:
* binding: Alkaner har kun enkeltbindinger, mens alkener har mindst en dobbeltbinding.
* Hybridisering: Carbonatomerne i alkaner er sp 3 hybridiseret, mens de i alkener er sp 2 hybridiseret. Dette påvirker deres bindingsvinkler og former.
* reaktivitet: Alkener er mere reaktive end alkaner på grund af tilstedeværelsen af dobbeltbindingen, som kan gennemgå tilsætningsreaktioner.
Kortfattet: Alkaner er mættede kulbrinter med kun enkeltbindinger, mens alkener er umættede carbonhydrider med mindst en dobbeltbinding. Denne forskel i bindingsstruktur fører til betydelige forskelle i deres kemiske egenskaber og reaktivitet.
Sidste artikelHvordan forbereder du 0,1 m Tris HCl -puffer af pH 8?
Næste artikelEr natriumnitrat fast eller vandig?
 Varme artikler
Varme artikler
-
 Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd
Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd -
 Ny teknik muliggør 3D-print med pasta af silikonepartikler i vandNy teknik udgivet i Avancerede materialer viser processen med 3-D-print af silikonegummi. Kredit:Orlin Velev, NC State University Ved at bruge principperne bag dannelsen af sandslotte fra vådt
Ny teknik muliggør 3D-print med pasta af silikonepartikler i vandNy teknik udgivet i Avancerede materialer viser processen med 3-D-print af silikonegummi. Kredit:Orlin Velev, NC State University Ved at bruge principperne bag dannelsen af sandslotte fra vådt -
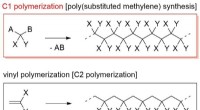 Udvikling af nye smarte bløde materialer:Syntese af en pH-reagerende dendroniseret poly(substituere…Vinylpolymerisation og C1-polymerisation. Kredit:Ehime Unisity C1-polymerisation er en nyttig teknik til fremstilling af polymerer med en carbon-carbon-hovedkæde. Denne teknik konstruerer en polym
Udvikling af nye smarte bløde materialer:Syntese af en pH-reagerende dendroniseret poly(substituere…Vinylpolymerisation og C1-polymerisation. Kredit:Ehime Unisity C1-polymerisation er en nyttig teknik til fremstilling af polymerer med en carbon-carbon-hovedkæde. Denne teknik konstruerer en polym -
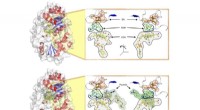 Hvordan et bestemt protein regulerer op til to tredjedele af verdens metanudledningOverfladeillustrationer af enzymet Mmp10, der viser (øverst) proteinet med det komplette sæt af co-faktorer, der kræves for at den enzymatiske reaktion kan forekomme (nemlig:SF4-klyngen, SAM og cobala
Hvordan et bestemt protein regulerer op til to tredjedele af verdens metanudledningOverfladeillustrationer af enzymet Mmp10, der viser (øverst) proteinet med det komplette sæt af co-faktorer, der kræves for at den enzymatiske reaktion kan forekomme (nemlig:SF4-klyngen, SAM og cobala
- Sådan beregner du graden og vinklerne til pyramidehustakbyggeri
- Advarselstegn - hvor tidligt mennesker begyndte at male dyr
- Nye kontorer gør os mere imagebevidste
- 9 millioner cykler, men hvad med bilerne i Beijing?
- Glucosebindende molekyle kunne transformere behandlingen af diabetes
- Ammoniaknedbrydning for brintøkonomi, forbedring af brintudvindingseffektiviteten


