Hvilken egenskab ved begge carbon nad -silicium er uventede?
Her er hvorfor:
* Elektronegativitet: Både carbon og silicium er relativt elektronegativ sammenlignet med andre elementer i deres respektive perioder. Dette betyder, at de har en tendens til at tiltrække elektroner mod sig selv og danner stærke kovalente bindinger.
* størrelse: Silicium er imidlertid markant større end kulstof. Denne forskel i størrelse vil typisk føre til svagere bindinger for silicium sammenlignet med kulstof.
På trods af dette udviser begge elementer en bemærkelsesværdig evne til at danne lange kæder og komplekse strukturer. Dette skyldes primært deres evne til at danne flere obligationer (inklusive dobbelt- og tredobbelt obligationer) og deres evne til at binde sig til sig selv (catenation).
Hvorfor er dette uventet?
* størrelse: Den større størrelse af silicium antyder svagere bindinger og en lavere tendens til at danne lange kæder.
* Elektronegativitet: Den relativt høje elektronegativitet af begge elementer indebærer en stærk præference for at danne enkeltbindinger, hvilket ville begrænse deres evne til at danne komplekse strukturer.
Imidlertid har både kulstof og silicium overvundet disse udfordringer og udviser uventede ligheder i deres evne til at danne komplekse molekyler. Denne delte egenskab er vigtig for eksistensen af organiske forbindelser og siliciumbaserede materialer med forskellige egenskaber.
Sidste artikelHar NaCl større gitterenergi end MGO?
Næste artikelHvad er formlen for rubidiumperoxid?
 Varme artikler
Varme artikler
-
 Forskere har låst op for hemmeligheder om konstrueret proteinreceptor, BILIllustration af kimærisk antigenreceptor (CAR). Kredit:Madelin Lum/ USC Viterbi School of Engineering Kræft er fortsat den næstførende dødsårsag i USA. Dette år, anslået 1,7 millioner nye tilfælde
Forskere har låst op for hemmeligheder om konstrueret proteinreceptor, BILIllustration af kimærisk antigenreceptor (CAR). Kredit:Madelin Lum/ USC Viterbi School of Engineering Kræft er fortsat den næstførende dødsårsag i USA. Dette år, anslået 1,7 millioner nye tilfælde -
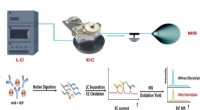 Forskere låser op for en ny metode til at teste proteinbaserede lægemidlerWorkflow af NJIT-teamets CMS-metode, der kombinerer væskekromatografi (LC), elektrokemisk oxidation (EC) og massespektrometri (MS)-baseret kvantitativ måling af proteinoverflod. Kredit:NJIT New Jer
Forskere låser op for en ny metode til at teste proteinbaserede lægemidlerWorkflow af NJIT-teamets CMS-metode, der kombinerer væskekromatografi (LC), elektrokemisk oxidation (EC) og massespektrometri (MS)-baseret kvantitativ måling af proteinoverflod. Kredit:NJIT New Jer -
 Efterladt korn fra bryggerier kunne omdannes til brændsel til boligerKredit:CC0 Public Domain En forsker fra Queens University Belfast har udviklet en billig teknik til at omdanne rester af byg fra alkoholbryggerier til kulstof, som kunne bruges som vedvarende bræn
Efterladt korn fra bryggerier kunne omdannes til brændsel til boligerKredit:CC0 Public Domain En forsker fra Queens University Belfast har udviklet en billig teknik til at omdanne rester af byg fra alkoholbryggerier til kulstof, som kunne bruges som vedvarende bræn -
 Genredigeringsteknik gør det muligt for silkeorme at producere edderkoppesilkeEn analyse af transformerede kokoner. Morfologi af WT-1, FibH+/-, FibH-/-, WT-2, MaSp1+/-, og MaSp1+/+ kokoner. Målestok repræsenterer 1 cm. Kredit:Jun Xu Et team af forskere tilknyttet flere inst
Genredigeringsteknik gør det muligt for silkeorme at producere edderkoppesilkeEn analyse af transformerede kokoner. Morfologi af WT-1, FibH+/-, FibH-/-, WT-2, MaSp1+/-, og MaSp1+/+ kokoner. Målestok repræsenterer 1 cm. Kredit:Jun Xu Et team af forskere tilknyttet flere inst
- Lokalisering af kilderne til trans-Pacific støv
- Undersøgelse viser, hvordan californiske arbejdsgivere undgår at betale lovlige krav til arbejdere…
- Team afslører regler for fremstilling af ribben
- Har NaCl større gitterenergi end MGO?
- Hvordan skriver du 0,56 0,067 0,6 0,65 og 0,605 i rækkefølge mindste til største?
- Hvorfor en kommende aftale gør os mindre produktive


