Hvorfor har Pentanal et højere kogepunkt end 3-methylbutanal?
* molekylær form og overfladeareal: Pentanal er et lige kædet molekyle, mens 3-methylbutanal er forgrenet. Lige kæde-molekyler har et større overfladeareal til kontakt, hvilket muliggør stærkere London-spredningskræfter (van der Waals-styrker).
* Polaritet: Begge molekyler har en polær carbonylgruppe (C =O), men Pentanals lige kæde muliggør et mere lineært arrangement af den polære gruppe, hvilket forbedrer dens evne til at interagere med andre pentanale molekyler.
Kortfattet:
* Pentanal har et større overfladeareal på grund af sin lige kæde, hvilket fører til stærkere London -spredningskræfter.
* Den lineære struktur af pentanal giver mulighed for stærkere dipol-dipol-interaktioner mellem carbonylgrupperne.
Disse stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket resulterer i et højere kogepunkt for pentanal sammenlignet med 3-methylbutanal.
Sidste artikelHvad er kogepunktet for koncentreret vandig opløsning natriumchlorid?
Næste artikelHvad er farverne på koboltforbindelser?
 Varme artikler
Varme artikler
-
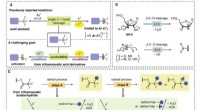 Brug af en radikal til at bryde C-F-bindinger en ad gangenStrategier for C-F-bindingsfunktionaliseringer af CF3-grupper. (A) Defluorering af CF3-grupper til difluorsubstituerede mellemprodukter (øverst) og det udfordrende mål om kontrollerbart at generere di
Brug af en radikal til at bryde C-F-bindinger en ad gangenStrategier for C-F-bindingsfunktionaliseringer af CF3-grupper. (A) Defluorering af CF3-grupper til difluorsubstituerede mellemprodukter (øverst) og det udfordrende mål om kontrollerbart at generere di -
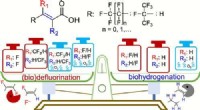 Under anaerobe forhold kan almindelige mikrobielle samfund bryde den ultra-stærke kulstof-fluor-bin…Kredit:Yaochun Yu et al., Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c05509 Ingeniører ved University of California Riverside er de første til at rapportere selektiv nedbrydning
Under anaerobe forhold kan almindelige mikrobielle samfund bryde den ultra-stærke kulstof-fluor-bin…Kredit:Yaochun Yu et al., Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c05509 Ingeniører ved University of California Riverside er de første til at rapportere selektiv nedbrydning -
 Kemikere opnår molekylær redigeringScripps Research og University of California, Los Angeles, har udviklet metoder til at modificere en bred klasse af kemiske forbindelser, der almindeligvis bruges til at bygge lægemiddelmolekyler. Bil
Kemikere opnår molekylær redigeringScripps Research og University of California, Los Angeles, har udviklet metoder til at modificere en bred klasse af kemiske forbindelser, der almindeligvis bruges til at bygge lægemiddelmolekyler. Bil -
 Forskere udvikler prober designet til at afsløre de fysiske kræfter inde i levende celler; en verd…Molekylær struktur af det kemiske værktøj (til venstre), blå:elektronfattig, rød:elektronrig, der ændrer farve som rejer under madlavning (midten, inspiration fra fiskemarkedet i Barcelona) for at afs
Forskere udvikler prober designet til at afsløre de fysiske kræfter inde i levende celler; en verd…Molekylær struktur af det kemiske værktøj (til venstre), blå:elektronfattig, rød:elektronrig, der ændrer farve som rejer under madlavning (midten, inspiration fra fiskemarkedet i Barcelona) for at afs
- Hvad var Hans og Zacharias bidrag til videnskab?
- Sådan beregnes et tværsnitsområde
- Hvilke adskillelsesteknikker vil gælde for smør fra ostemasse?
- Amerikanske offentlige virksomheder har stadig kortere levetid, siger forskning
- Biomimetisk strategi fører til stærke, genanvendeligt gummi
- Hvilken slags insekter lever i den løvfældende skov?


