Hvad er kogepunktet for koncentreret vandig opløsning natriumchlorid?
* kogepunkthøjde: Tilføjelse af et opløst stof (som NaCl) til et opløsningsmiddel (som vand) hæver opløsningens kogepunkt. Dette fænomen kaldes kogepunkthøjde.
* Koncentration betyder noget: Jo højere koncentration af det opløste stof, jo større er stigningen i kogepunktet.
For at beregne kogepunktet har du brug for:
1. Molaliteten af opløsningen: Molalitet er antallet af mol opløst stof pr. Kg opløsningsmiddel.
2. Molal kogepunkthøjde konstant (KB) til vand: Denne værdi er 0,512 ° C/m.
Formel:
* ΔTb =kb * m
* ΔTB =Ændring i kogepunkt
* Kb =molal kogepunktstigning konstant
* m =molalitet af opløsningen
Eksempel:
Lad os sige, at du har en 1 molal (1 m) opløsning af NaCl. Ændringen i kogepunktet ville være:
* ΔTB =(0,512 ° C/m) * (1 m) =0,512 ° C
Da det normale kogepunkt af vand er 100 ° C, ville kogepunktet for 1 M NaCl -opløsningen være:
* 100 ° C + 0,512 ° C =100,512 ° C
Vigtig note: Denne beregning antager den ideelle opførsel af løsningen. I virkeligheden kan kogepunkthøjden være lidt anderledes på grund af interaktioner mellem ionerne i opløsningen.
Lad mig vide, om du har koncentrationen af NaCl -opløsningen, og jeg kan hjælpe dig med at beregne kogepunktet!
Sidste artikelBeskriv 3 specielle egenskaber ved mineraler?
Næste artikelHvorfor har Pentanal et højere kogepunkt end 3-methylbutanal?
 Varme artikler
Varme artikler
-
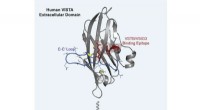 Ny indsigt i et kræftbeskyttende protein kan guide en ny generation af kræftbehandlingerVed hjælp af en kombination af beregning og eksperiment, forskere var i stand til at kortlægge formen på VISTA, et checkpoint protein, der forsvarer kræftceller mod immunsystemangreb, samt den del af
Ny indsigt i et kræftbeskyttende protein kan guide en ny generation af kræftbehandlingerVed hjælp af en kombination af beregning og eksperiment, forskere var i stand til at kortlægge formen på VISTA, et checkpoint protein, der forsvarer kræftceller mod immunsystemangreb, samt den del af -
 Ny undersøgelse afslører evolutionens hemmeligheder på molekylært niveauKredit:Australian National University En undersøgelse ledet af ANU har genfortalt den evolutionære historie af et moderne enzym med en teknik kaldet forfædres proteinrekonstruktion - en opdagelse,
Ny undersøgelse afslører evolutionens hemmeligheder på molekylært niveauKredit:Australian National University En undersøgelse ledet af ANU har genfortalt den evolutionære historie af et moderne enzym med en teknik kaldet forfædres proteinrekonstruktion - en opdagelse, -
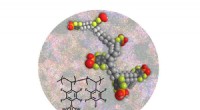 Banebrydende materiale gør vej til brintbrug til brændselsceller under varme, tørre forholdForskere har udviklet en protonleder til brændselsceller baseret på polystyrenphosphonsyrer, der opretholder høj protonisk ledningsevne ved høje temperaturer uden vand. Kredit:Los Alamos National Labo
Banebrydende materiale gør vej til brintbrug til brændselsceller under varme, tørre forholdForskere har udviklet en protonleder til brændselsceller baseret på polystyrenphosphonsyrer, der opretholder høj protonisk ledningsevne ved høje temperaturer uden vand. Kredit:Los Alamos National Labo -
 Ny deaktiveringsmekanisme for switchproteiner fundetKlaus Gerwert, Till Rudack og Carsten Kötting (fra venstre) har undersøgt switch -proteiner i årevis, for eksempel Ras -proteinet afbildet her. Kredit:RUB En ny mekanisme til deaktivering af switc
Ny deaktiveringsmekanisme for switchproteiner fundetKlaus Gerwert, Till Rudack og Carsten Kötting (fra venstre) har undersøgt switch -proteiner i årevis, for eksempel Ras -proteinet afbildet her. Kredit:RUB En ny mekanisme til deaktivering af switc
- Hvad er den videnskabelige definition af vævskultur?
- Amerikansk dronekrigsførelse står over for spørgsmål om legitimitet, viser undersøgelse af mili…
- Hvad er blandinger af elementer og forbindelser sammensat af?
- Hvordan kan mine briller skifte fra gennemsigtige,
- For evigt giftige kemikalier fundet i postevand rejser spørgsmål for forskere
- Russiske fysikere postulerer eksistensen af mørkt stof-baserede Bose-stjerner


