Hvorfor er ammoniak mere opløselig end carbontetrachlorid?
1. Hydrogenbinding:
* ammoniak: Ammoniak kan danne brintbindinger med vandmolekyler. Nitrogenatomet i ammoniak har et ensomt par elektroner, der kan danne en brintbinding med det delvist positive brintatom af vand.
* carbon tetrachlorid: Carbon -tetrachlorid kan ikke danne hydrogenbindinger. Carbonatomet er omgivet af fire kloratomer, som er meget elektronegative, hvilket gør carbonatomet lidt positivt. Chloratomerne er imidlertid for elektronegative til at danne hydrogenbindinger.
2. Polaritet:
* ammoniak: Ammoniak er et polært molekyle. Nitrogenatomet har et ensomt par elektroner, hvilket gør det lidt negativt, mens brintatomerne er lidt positive.
* carbon tetrachlorid: Carbon -tetrachlorid er et ikke -polært molekyle. Den tetrahedrale form og symmetriske fordeling af kloratomer resulterer i lige deling af elektroner, hvilket fører til intet netto dipolmoment.
3. "Som opløser som":
* Vand er et polært opløsningsmiddel, og ammoniakens polaritet giver det let at opløses i vand.
* Carbon -tetrachlorid er ikke -polært og opløses derfor ikke godt i vand. I stedet ville det opløses i ikke -polære opløsningsmidler som hexan eller benzen.
Kortfattet:
Ammoniakens evne til at danne hydrogenbindinger med vand, dens polaritet og "som opløser som" princip bidrager alle til dets høje opløselighed i vand sammenlignet med carbontetrachlorid.
Sidste artikelHvor mange valenselektroner har BI?
Næste artikelHvad er den relative formelmasse af natriumhydroxid?
 Varme artikler
Varme artikler
-
 Nye materialer forbedrer leveringen af terapeutisk messenger-RNAMIT-forskere har designet nanopartikler, der kan levere messenger-RNA til specifikke organer. På dette billede, lungeceller, der udtrykker det syntetiske mRNA, viser sig som røde. Kredit:Piotr Kowalsk
Nye materialer forbedrer leveringen af terapeutisk messenger-RNAMIT-forskere har designet nanopartikler, der kan levere messenger-RNA til specifikke organer. På dette billede, lungeceller, der udtrykker det syntetiske mRNA, viser sig som røde. Kredit:Piotr Kowalsk -
 Kemiker forklarer videnskaben bag fyrværkeriUanset om du vil se fyrværkeri langs Bostons Esplanade eller et andet sted den fjerde juli, du vil ikke være den eneste, der slapper af denne ferie. Det er fordi fyrværkeri, forklarede Michael Pollas
Kemiker forklarer videnskaben bag fyrværkeriUanset om du vil se fyrværkeri langs Bostons Esplanade eller et andet sted den fjerde juli, du vil ikke være den eneste, der slapper af denne ferie. Det er fordi fyrværkeri, forklarede Michael Pollas -
 Forskere opnår nye resultater på dielektronisk rekombinationspræcisionsspektroskopiFig. 1 DR-spektrum og plasmahastighedskoefficient for carbonlignende Ca 14 + ioner. Kredit:IMP Forskere ved Institute of Modern Physics (IMP) ved det kinesiske videnskabsakademi (CAS) og deres
Forskere opnår nye resultater på dielektronisk rekombinationspræcisionsspektroskopiFig. 1 DR-spektrum og plasmahastighedskoefficient for carbonlignende Ca 14 + ioner. Kredit:IMP Forskere ved Institute of Modern Physics (IMP) ved det kinesiske videnskabsakademi (CAS) og deres -
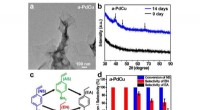 Heterofase nanostrukturer, der bidrager til effektiv katalyse(a) TEM-billede af a-PdCu nanoark. (b) XRD-mønstre af den som syntetiserede (0 dage) a-PdCu og a-PdCu efter ældning i 14 dage. (c) Hydrogeneringsreaktion af 4-nitrostyren (stuetemperatur, H2 ballon).
Heterofase nanostrukturer, der bidrager til effektiv katalyse(a) TEM-billede af a-PdCu nanoark. (b) XRD-mønstre af den som syntetiserede (0 dage) a-PdCu og a-PdCu efter ældning i 14 dage. (c) Hydrogeneringsreaktion af 4-nitrostyren (stuetemperatur, H2 ballon).
- NASAs Juno giver højopløsningsvisninger af Europas iskolde skal
- Hvordan løser man samfundsmæssige udfordringer ved at udnytte synergier i rum og energi
- Undersøgelse analyserer virkningen af den økonomiske cyklus på midlertidig invaliditet
- Hvorfor masseskyderier ikke fører til våbenkontrol
- Jord eller planter vil absorbere mere CO2, når kulstofniveauet stiger - men ikke begge dele
- Hvordan konverterer du 5,7 til et blandet nummer?


