Hvorfor er KCL opløselig i vand?
1. Polaritet:
* Vand er et polært molekyle, hvilket betyder, at det har en positiv og negativ ende på grund af den ujævne deling af elektroner.
* KCl er en ionisk forbindelse, hvilket betyder, at den består af positivt ladede kaliumioner (K+) og negativt ladede chloridioner (Cl-).
2. Ion-dipol-interaktioner:
* Den positive ende af vandmolekyler (hydrogenatomer) tiltrækkes af de negativt ladede chloridioner.
* Tilsvarende tiltrækkes den negative ende af vandmolekyler (iltatomer) af de positivt ladede kaliumioner.
* Disse attraktioner mellem de ladede ioner og de polære vandmolekyler kaldes ion-dipolinteraktioner.
3. Hydrering:
* De stærke ion-dipol-interaktioner overvinder de elektrostatiske kræfter, der holder kalium- og chloridioner sammen i den faste krystalgitter.
* Vandmolekyler omgiver ionerne, adskiller dem effektivt og opløses KCL. Denne proces kaldes hydrering.
4. Entropi:
* Opløsningen af KCl i vand øger systemets entropi (lidelse). Ionerne er spredt i hele opløsningen og øger systemets tilfældighed. Denne stigning i entropi favoriserer også opløsningsprocessen.
Sammenfattende skyldes KCLs opløselighed i vand de stærke ion-dipol-interaktioner mellem de polære vandmolekyler og de ladede ioner af KCL, hvilket fører til hydrering og en stigning i entropi.
Sidste artikelVanddamp, der indeholder kemikalie fra luftforurening?
Næste artikelHvorfor ilt et mineral?
 Varme artikler
Varme artikler
-
 Ny syntesestrategi fremskynder identifikation af enklere versioner af et naturproduktBaylor University professor og kemiker Daniel Romo, Ph.D., diskuterer forskning med ph.d.-kandidat Christian M. Chaheine, medforfatter på ny syntesestrategi. Undersøgelsen er publiceret i Naturkemi
Ny syntesestrategi fremskynder identifikation af enklere versioner af et naturproduktBaylor University professor og kemiker Daniel Romo, Ph.D., diskuterer forskning med ph.d.-kandidat Christian M. Chaheine, medforfatter på ny syntesestrategi. Undersøgelsen er publiceret i Naturkemi -
 Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org
Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org -
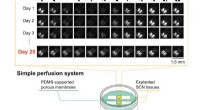 Hjernevæv holdt i live i ugevis på en kunstig membranNederst:mikroenhedsopsætningen med eksplanteret suprachiasmatic nucleus (SCN) væv. Øverst:rytmisk døgnaktivitet var stadig tydelig efter 25 dage, som angivet ved bioluminescensbilleddannelse. Kredit:R
Hjernevæv holdt i live i ugevis på en kunstig membranNederst:mikroenhedsopsætningen med eksplanteret suprachiasmatic nucleus (SCN) væv. Øverst:rytmisk døgnaktivitet var stadig tydelig efter 25 dage, som angivet ved bioluminescensbilleddannelse. Kredit:R -
 Bygge broer med vandmolekylerVandmolekyler danner komplekse strukturer på en jernoxidoverflade. Kredit:Vienna University of Technology Et hold ved TU Wien har nu beviset bag spekulationerne om, at vandmolekyler kan danne komp
Bygge broer med vandmolekylerVandmolekyler danner komplekse strukturer på en jernoxidoverflade. Kredit:Vienna University of Technology Et hold ved TU Wien har nu beviset bag spekulationerne om, at vandmolekyler kan danne komp
- Nyt NASA-missionskoncept, der sigter mod at studere, hvorfor planeter mister deres atmosfære
- Giver den tyske rabat på brændstof videre til forbrugerne?
- Hvad sker der med spild af PPE under coronavirus-pandemien?
- Undersøgelse af de mange smagsvarianter af spiselige myrer
- Team fremsætter ideer om mørkt stofs natur
- Hjælper det virkelig børn at forbyde bøger? En ekspert i barndomsundervisning vejer ind


