Hvorfor diffus natriumion langsomt end en klorion?
* størrelse: Natriumioner (Na+) er mindre end chloridioner (Cl-). Mindre ioner diffunderer generelt hurtigere, fordi de oplever mindre modstand fra det omgivende medium.
* Hydrering: Ioner i opløsning er omgivet af vandmolekyler, der danner en hydratiseringsskal. Styrken af hydratiseringsskallen påvirker diffusion. Chloridioner har en svagere hydratiseringsskal end natriumioner, hvilket betyder, at de er mindre besat af vandmolekyler og kan diffundere lettere.
* opladning: Chloridioner har en enkelt negativ ladning, mens natriumioner har en enkelt positiv ladning. Anklagen for en ion bidrager også til dens interaktion med vandmolekyler, og dette kan påvirke diffusionshastigheder. Imidlertid er størrelsen og hydratiseringsskaleffekterne generelt mere betydningsfulde.
faktorer, der kan påvirke de relative diffusionshastigheder for ioner:
* Temperatur: Højere temperaturer fører til hurtigere diffusion.
* Koncentrationsgradient: En stejlere koncentrationsgradient resulterer i hurtigere diffusion.
* medium: Viskositeten og sammensætningen af mediet kan påvirke diffusionshastigheder.
Kortfattet:
Mens det er fristende at tro, at tungere ioner ville diffundere langsommere, størrelse, hydrering og ladning Af ionerne er vigtigere faktorer. I de fleste tilfælde diffunderer chloridioner hurtigere end natriumioner .
Sidste artikelHvad er produktet af reaktion mellem stivelse og jod?
Næste artikelHvilke slags ioner produceres, når Na2CO3 opløses?
 Varme artikler
Varme artikler
-
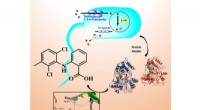 Nye antibakterielle lægemidler udviklet ved University of Eastern FinlandDen nye LsrK -hæmmer udviklet af forskerne (strukturbilledet til venstre) binder sig til det aktive område af målproteinet (atombillede i bunden). Ved at hæmme funktionen af LsrK, det er muligt at b
Nye antibakterielle lægemidler udviklet ved University of Eastern FinlandDen nye LsrK -hæmmer udviklet af forskerne (strukturbilledet til venstre) binder sig til det aktive område af målproteinet (atombillede i bunden). Ved at hæmme funktionen af LsrK, det er muligt at b -
 Opdagelsen af livsforlængende vej hos orme viser en ny måde at studere aldring påCaenorhabditis elegans. Kredit:Wikipedia Et enzymblokerende molekyle kan forlænge levetiden for Caenorhabditis elegans rundorme med så meget som 45 procent, hovedsagelig ved at modulere en cannabi
Opdagelsen af livsforlængende vej hos orme viser en ny måde at studere aldring påCaenorhabditis elegans. Kredit:Wikipedia Et enzymblokerende molekyle kan forlænge levetiden for Caenorhabditis elegans rundorme med så meget som 45 procent, hovedsagelig ved at modulere en cannabi -
 Forskere skaber en ny klasse af hastighedsfølsomme mekaniske metamaterialerKredit:Delft University of Technology Forskere ved Institut for Biomekanisk Teknik ved Delft University of Technology har skabt en ny klasse af metamaterialer, der dynamisk kan ændre deres mekanis
Forskere skaber en ny klasse af hastighedsfølsomme mekaniske metamaterialerKredit:Delft University of Technology Forskere ved Institut for Biomekanisk Teknik ved Delft University of Technology har skabt en ny klasse af metamaterialer, der dynamisk kan ændre deres mekanis -
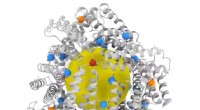 Nye bure for at fange molekyler skubber grænserne for proteindesignProteindesign er et populært og hurtigt voksende felt, med forskere, der konstruerer nye proteinbure-kapsellignende nanostrukturer til formål som genterapi og målrettet lægemiddellevering. Mange af di
Nye bure for at fange molekyler skubber grænserne for proteindesignProteindesign er et populært og hurtigt voksende felt, med forskere, der konstruerer nye proteinbure-kapsellignende nanostrukturer til formål som genterapi og målrettet lægemiddellevering. Mange af di
- Forskning i havlampretter kaster lys over, hvordan stresshormoner udviklede sig
- Forvandler grafit til diamant
- Australien kan udvande ulovlige skovlove - her er hvorfor det er en dårlig idé
- Hvad produceres når 1-buten reagerer med hcl?
- Ny retsmedicinsk metode har til formål at forudsige, hvordan en person ser ud fra DNA-prøve
- Hvordan tyktarmen prioriterer gasdetox frem for energiforbrug


