Hvorfor er opløsningen af ammoniumchlorid en eksoterm reaktion?
* Breaking Bonds: Når NH₄CL opløses, brydes de ioniske bindinger mellem NH₄⁺- og CL⁻ioner, hvilket kræver energiindgang.
* Hydrering: Ionerne bliver derefter omgivet af vandmolekyler (hydrering), der frigiver energi.
* netto energiændring: I tilfælde af NH₄CL er den energi, der kræves for at bryde de ioniske bindinger, større end den energi, der frigives under hydrering. Dette betyder, at den overordnede proces absorberer energi fra omgivelserne, hvilket gør den endotermisk.
Bevis:
* køleeffekt: Du kan observere denne endotermiske natur ved at føle bægerglas, der indeholder det opløste ammoniumchlorid. Løsningen føles koldere, fordi den absorberer varme fra omgivelserne.
* entalpiændring: Enthalpyændringen (ΔH) til opløsning af NH₄CL er positiv, hvilket er et kendetegn ved endotermiske reaktioner.
Så hvorfor synes nogen måske, at det er eksoterm?
Det er muligt, at forvirringen opstår ved at observere den hurtige opløste NH₄CL. Denne hurtige opløsning kan give indtryk af, at varme frigives, men det er faktisk resultatet af den endotermiske proces, der tegner varme fra omgivelserne.
 Varme artikler
Varme artikler
-
 Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der
Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der -
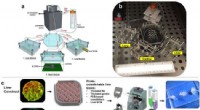 Forskere udvikler body-on-a-chip-system til at fremskynde test af nye lægemidlerOverordnet design- og implementeringsstrategi for det 3-vævsrepræsentative organ-på-en-chip-system ved hjælp af en række biofabrikationstilgange. (en, b) Illustration og fotografi af det modulære mult
Forskere udvikler body-on-a-chip-system til at fremskynde test af nye lægemidlerOverordnet design- og implementeringsstrategi for det 3-vævsrepræsentative organ-på-en-chip-system ved hjælp af en række biofabrikationstilgange. (en, b) Illustration og fotografi af det modulære mult -
 Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa
Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa -
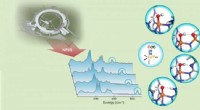 Forskere undersøger hydrogenbindinger ved hjælp af ny teknikHydrogenbindingsstyrke til jern(III)-oxido/hydroxido (FeIII-O/OH)-enheder i non-heme jernkomplekser afsløres af FeIII-O/OH-strækningsvibrationer detekteret med 57Fe nuklear resonans vibrationsspektros
Forskere undersøger hydrogenbindinger ved hjælp af ny teknikHydrogenbindingsstyrke til jern(III)-oxido/hydroxido (FeIII-O/OH)-enheder i non-heme jernkomplekser afsløres af FeIII-O/OH-strækningsvibrationer detekteret med 57Fe nuklear resonans vibrationsspektros
- Ønsker er lighederne og forskelle mellem transformering af energi og en vandbroelektrisk dæmningsv…
- Opfattelse af rovdyr:Forståelse af, hvordan planter 'fornemmer' planteædende angreb
- Boeing inkluderede ikke vigtige sikkerhedsforanstaltninger på 737 MAX:rapport
- Billede:Luftfartøjets næsekuppel vurderet i ESA Hertz-kammer
- Hvilken type energiressourcer betragtes som biomassebrændstoffer?
- Hvad fortæller et elementer atomnummer dig?


