Hvad er den intermolekylære binding af bromchlorid?
Her er hvorfor:
* Elektronegativitet: Klor er mere elektronegativ end brom, hvilket betyder, at det tiltrækker elektroner stærkere. Dette skaber en delvis negativ ladning (Δ-) på kloratomet og en delvis positiv ladning (Δ+) på bromatomet.
* dipol-dipolinteraktion: Det delvise positive ende af et BRCL -molekyle tiltrækkes af den delvise negative ende af et andet BRCL -molekyle. Disse attraktioner er svagere end kovalente bindinger, men stadig betydningsfulde til at påvirke BRCL's fysiske egenskaber.
Mens spredningskræfter også findes mellem alle molekyler, er de svagere end dipol-dipolkræfter i BRCL på grund af dens betydelige polaritet.
Sidste artikelHvilke obligationsformer mellem kobolt og brom?
Næste artikelHvad laver jern- og sølvnitrat?
 Varme artikler
Varme artikler
-
 Forskere foreslår nye selektive reduktive amineringskatalysatorer med forbedret stabilitetGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c00800 Primære aminer og sekundære iminer er nøglemellemprodukter, der i vid udstrækning anvendes
Forskere foreslår nye selektive reduktive amineringskatalysatorer med forbedret stabilitetGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c00800 Primære aminer og sekundære iminer er nøglemellemprodukter, der i vid udstrækning anvendes -
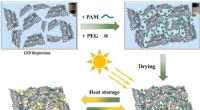 Forskere foreslår et-trins strategi til at syntetisere grafenbaserede sammensatte faseændringsmate…Skematisk diagram af PEG/GO-PAM-sammensatte PCM-syntese. Kredit:LI Yangeng Grafenbaserede kompositfaseforandringsmaterialer (PCMer) udviser et stort potentiale inden for konvertering og lagring af
Forskere foreslår et-trins strategi til at syntetisere grafenbaserede sammensatte faseændringsmate…Skematisk diagram af PEG/GO-PAM-sammensatte PCM-syntese. Kredit:LI Yangeng Grafenbaserede kompositfaseforandringsmaterialer (PCMer) udviser et stort potentiale inden for konvertering og lagring af -
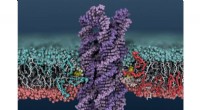 DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykkeEt syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo Et nyt syntetisk enzym, fremstillet af DNA frem for
DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykkeEt syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo Et nyt syntetisk enzym, fremstillet af DNA frem for -
 Hook-on medicin:Ny leveringsstrategi for K-Ras disruptionDr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet
Hook-on medicin:Ny leveringsstrategi for K-Ras disruptionDr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet
- Hvor meget energi i kilokalorier absorberes, når 9,0 mol vand fordamper?
- Hvilken klippe kan dannes på Eyjafjallajokull -vulkanen?
- Hvad er formelmassen for ammoniumion?
- Hvordan pakkes partiklerne i gas?
- Google News serverer konservative og liberale lignende resultater, men favoriserer mainstream medier
- Antallet af dødsfald i Europa stiger til 65


