Hvorfor opløses NaCl mere i vand end jod?
Forståelse af opløselighed
* Polar vs. ikke -polær: Opløselighed afhænger af princippet "som opløser som". Polære stoffer (som vand) opløses godt i andre polære stoffer, og ikke -polære stoffer (som olie) opløses godt i andre ikke -polære stoffer.
* ioniske forbindelser: Ioniske forbindelser som NaCI dannes af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (ANION).
Hvorfor NACL opløses godt i vand
1. Polaritet af vand: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brintside) og en lidt negativ ende (ilt side). Denne polaritet giver dem mulighed for at interagere med ionerne i NaCl.
2. ioniske interaktioner: Når NaCl tilsættes til vand, tiltrækker de positive ende af vandmolekyler de negative chloridioner (Cl-), og den negative ende af vandmolekyler tiltrækker de positive natriumioner (Na+).
3. hydrering: Denne attraktion mellem vandmolekyler og ioner kaldes hydrering. Vandmolekylerne omgiver og isolerer effektivt ionerne fra hinanden og bryder de ioniske bindinger, der holder NaCl -krystalen sammen.
Hvorfor opløses ikke godt i vand
* ikke -polær karakter af iod: Jod (I2) er et ikke -polært molekyle. Det har ikke en betydelig adskillelse af ladning som vand, hvilket gør det vanskeligt for vandmolekyler at interagere med det.
* svage van der Waals Forces: Jodmolekyler holdes sammen af svage van der Waals -styrker. Disse kræfter er svagere end hydrogenbindingen mellem vandmolekyler, hvilket gør det vanskeligt for vand at overvinde dem og opløses iod.
Kortfattet: NaCl opløser mere i vand end jod, fordi:
* NaCl er ionisk og vand er polær: Stærke elektrostatiske interaktioner forekommer mellem vandmolekyler og ionerne i NaCl.
* jod er ikke -polær: Vandmolekyler kan ikke effektivt interagere med de ikke -polære jodmolekyler.
Sidste artikelHvad er nogle måder at finde tæthed af NaCl, som er vandopløselig?
Næste artikelHydrogenion har en afgift for hvad?
 Varme artikler
Varme artikler
-
 Omvendt brændselscelle omdanner affaldskulstof til værdifulde produkter med rekordhastighederVenstre mod højre:Adnan Ozden, Joshua Wicks, og F. Pelayo García de Arquer er blandt teammedlemmerne, der har designet en elektrolysator, der omdanner CO 2 til værdifulde produkter 10 gange hurtiger
Omvendt brændselscelle omdanner affaldskulstof til værdifulde produkter med rekordhastighederVenstre mod højre:Adnan Ozden, Joshua Wicks, og F. Pelayo García de Arquer er blandt teammedlemmerne, der har designet en elektrolysator, der omdanner CO 2 til værdifulde produkter 10 gange hurtiger -
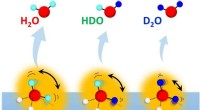 Indvirkningen af molekylær rotation på en ejendommelig isotopeffekt på vandhydrogenbindingerDesorption af vandisotopomerer (H 2 Åh, HDO og D 2 O) fra overflader af isotopblandet is med forskellige H/D-sammensætninger. Kredit:NINS/IMS Kvantenaturen af brintbindinger i vand manifeste
Indvirkningen af molekylær rotation på en ejendommelig isotopeffekt på vandhydrogenbindingerDesorption af vandisotopomerer (H 2 Åh, HDO og D 2 O) fra overflader af isotopblandet is med forskellige H/D-sammensætninger. Kredit:NINS/IMS Kvantenaturen af brintbindinger i vand manifeste -
 Revolutionær proces kunne signalere en ny æra for gensynteseKunstnerens indtryk af klik-DNA processen. Kredit:Karl Harrison Et team af forskere ledet af University of Southampton har demonstreret en banebrydende ny metode til gensyntese - et vigtigt forskn
Revolutionær proces kunne signalere en ny æra for gensynteseKunstnerens indtryk af klik-DNA processen. Kredit:Karl Harrison Et team af forskere ledet af University of Southampton har demonstreret en banebrydende ny metode til gensyntese - et vigtigt forskn -
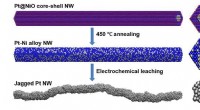 Ru overflader giver yderligere steder for energigenererende reaktioner i brændselscellerFlere aktive steder og mere overfladeareal på katalysatorer fremskynder den kemiske omdannelse af ilt og brint til vand og elektroner, generere elektricitet. Forskere udtænkte en ny synteserute for at
Ru overflader giver yderligere steder for energigenererende reaktioner i brændselscellerFlere aktive steder og mere overfladeareal på katalysatorer fremskynder den kemiske omdannelse af ilt og brint til vand og elektroner, generere elektricitet. Forskere udtænkte en ny synteserute for at


