Hvad gør noget solidt?
1. Stærke intermolekylære kræfter:
* atomer og molekyler er tæt pakket sammen. Dette betyder, at de er tæt nok til at opleve stærke attraktive kræfter mellem dem.
* Disse kræfter kan være:
* ioniske bindinger: Elektrostatisk tiltrækning mellem modsat ladede ioner.
* kovalente obligationer: Deling af elektroner mellem atomer.
* Metalliske obligationer: Deling af elektroner mellem et gitter af metalatomer.
* Hydrogenbindinger: Stærke dipol-dipolinteraktioner, der involverer brint.
* van der Waals Forces: Svage, midlertidige attraktioner mellem molekyler.
2. Fast struktur:
* Partikler i et solidt har et fast, gentagne arrangement. Denne struktur kaldes A krystalgitter . Dette arrangement gør faste stoffer stive og giver dem en bestemt form.
* der er meget lidt bevægelsesfrihed for partiklerne. De kan kun vibrere om deres faste positioner.
3. Inkomprimerbarhed:
* Fordi partikler allerede er tæt pakket, er faste stoffer meget vanskelige at komprimere.
her er en simpel analogi:
Forestil dig en flok kugler i en kasse.
* væske: Marmorerne er tæt sammen, men kan bevæge sig frit og give væsken sin fluiditet.
* fast: Marmorerne er tæt pakket og faste på plads, hvilket giver den faste sin stive form.
Vigtig note:
* Ikke alle faste stoffer er krystallinske. amorfe faste stoffer mangler en regelmæssig, gentagende struktur. Eksempler inkluderer glas, gummi og plast. De har dog stadig stærke intermolekylære kræfter og er stive.
Så i et nøddeskal er faste stoffer kendetegnet ved stærke intermolekylære kræfter, en fast struktur og meget begrænset partikelbevægelse. Denne kombination resulterer i deres stivhed, ukomprimerbarhed og bestemt form.
 Varme artikler
Varme artikler
-
 Det nye garn?!—Bærbart, vaskbare tekstilenheder er mulige med MXene-coated garnForskere fra Drexel Universitys College of Engineering og Center for Functional Fabrics har udviklet en måde at belægge garn med ledende MXene-materialer for at lave holdbare funktionelle tekstiler. K
Det nye garn?!—Bærbart, vaskbare tekstilenheder er mulige med MXene-coated garnForskere fra Drexel Universitys College of Engineering og Center for Functional Fabrics har udviklet en måde at belægge garn med ledende MXene-materialer for at lave holdbare funktionelle tekstiler. K -
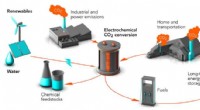 Plast, brændstoffer og kemiske råstoffer fra CO2? De arbejder på detForskere ved Stanford og SLAC arbejder på måder at omdanne kuldioxidaffald (CO2) til kemiske råvarer og brændstoffer, gør en potent drivhusgas til værdifulde produkter. Processen kaldes elektrokemisk
Plast, brændstoffer og kemiske råstoffer fra CO2? De arbejder på detForskere ved Stanford og SLAC arbejder på måder at omdanne kuldioxidaffald (CO2) til kemiske råvarer og brændstoffer, gør en potent drivhusgas til værdifulde produkter. Processen kaldes elektrokemisk -
 Forskere sporer proteinbinding, bygger syntetiske proteiner for at studere genekspressionKredit:Unsplash/CC0 Public Domain Hvordan husker en næse, at det er en næse? Eller husker et øje, at det er et øje? Mens forskere undersøger spørgsmålet om, hvordan celler husker, hvilken slags ce
Forskere sporer proteinbinding, bygger syntetiske proteiner for at studere genekspressionKredit:Unsplash/CC0 Public Domain Hvordan husker en næse, at det er en næse? Eller husker et øje, at det er et øje? Mens forskere undersøger spørgsmålet om, hvordan celler husker, hvilken slags ce -
 MasSpec Pen til nøjagtig kræftdetektion under operationMasSpec-pennen (til venstre) kunne en dag hjælpe kræftkirurger med at bestemme kanterne af tumorer i operationsstuen; forskere brugte det til at analysere skjoldbruskkirtelvæv ex vivo (til højre) og t
MasSpec Pen til nøjagtig kræftdetektion under operationMasSpec-pennen (til venstre) kunne en dag hjælpe kræftkirurger med at bestemme kanterne af tumorer i operationsstuen; forskere brugte det til at analysere skjoldbruskkirtelvæv ex vivo (til højre) og t
- Forskere udforsker masseadskillelse af galaksekuglehobe
- Hvorfor begyndte den overmættede opløsning at droppe små krystaller, når yderligere natriumthios…
- Hvordan Novichok er forskellig fra radioaktive giftstoffer - og hvad det betyder for dekontaminering
- Forsvundet eller uddød? Undersøgelse viser, at eksistensen af mere end 500 dyrearter forbliver u…
- Polymer, der heler som hud meget tæt på produktion i industriel skala
- Galileo-satellitter på toppen af raket til næste tirsdags flyvning


