Hvor mange elektroner mister metalnatriumatomerne, når de reagerer med en ikke -metal?
Her er hvorfor:
* natriums elektronkonfiguration: Natrium har en elektronkonfiguration af 1S² 2S²2p⁶3S¹. Det har en elektron i sin yderste skal (3S¹).
* tendens til at miste elektroner: Natrium ønsker at opnå en stabil oktet (8 elektroner) i sin yderste skal. Det er lettere for natrium at miste sin enkelt valenselektron end at få syv mere.
* Dannelse af kationer: Ved at miste en elektron bliver natrium en positivt ladet ion (Na⁺), kaldet en kation.
* reaktion med ikke -metaller: Ikke -metaller har på den anden side en tendens til at få elektroner til at afslutte deres oktet. Når natrium reagerer med en ikke -metal, får den ikke -metal det elektron, som natrium mister.
Denne overførsel af elektroner er det, der danner en ionisk binding, der fører til dannelsen af ioniske forbindelser.
 Varme artikler
Varme artikler
-
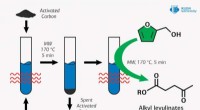 Chemist foreslår ny måde at forbedre brændstofkvaliteten ved hjælp af mikrobølgebestrålingKredit:RUDN Universitet En kemiker fra RUDN University har fundet en miljøvenlig måde at opnå estere af levulinsyre, der bruges som brændstoftilsætningsstof til kemisk syntese. Sammen med kolleger
Chemist foreslår ny måde at forbedre brændstofkvaliteten ved hjælp af mikrobølgebestrålingKredit:RUDN Universitet En kemiker fra RUDN University har fundet en miljøvenlig måde at opnå estere af levulinsyre, der bruges som brændstoftilsætningsstof til kemisk syntese. Sammen med kolleger -
 Ulovlig stofbrug kan være højere end hidtil antaget; svæver under særlige begivenhederKredit:CC0 Public Domain Amerikas narkotikaproblem kan være endnu værre, end embedsmænd er klar over. Og ulovlige stoffer indtages i højere grad under festlige begivenheder. Det er blot to af de k
Ulovlig stofbrug kan være højere end hidtil antaget; svæver under særlige begivenhederKredit:CC0 Public Domain Amerikas narkotikaproblem kan være endnu værre, end embedsmænd er klar over. Og ulovlige stoffer indtages i højere grad under festlige begivenheder. Det er blot to af de k -
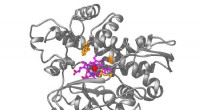 Syntetisk biologi bevæger sig ind i det unaturliges rigeEt kunstigt metalloenzym baseret på det naturlige enzym kaldet P450 (grå struktur). UC Berkeley-kemikere skabte et hæm-molekyle (magenta) med et indlejret iridium-atom (rødt), der, i E. coli, blev ind
Syntetisk biologi bevæger sig ind i det unaturliges rigeEt kunstigt metalloenzym baseret på det naturlige enzym kaldet P450 (grå struktur). UC Berkeley-kemikere skabte et hæm-molekyle (magenta) med et indlejret iridium-atom (rødt), der, i E. coli, blev ind -
 Evaluering af nye behandlingsplatforme til farmaceutisk produktionKredit:Olivia Morales Gonzales Medicinalindustrien er en af de mest relevante sektorer i nutidens økonomi. I mere end et århundrede har den farmaceutiske produktion været afhængig af batchprodukt
Evaluering af nye behandlingsplatforme til farmaceutisk produktionKredit:Olivia Morales Gonzales Medicinalindustrien er en af de mest relevante sektorer i nutidens økonomi. I mere end et århundrede har den farmaceutiske produktion været afhængig af batchprodukt
- Karakteristika for Salmonella Bakterier
- Flere amerikanere forventer at arbejde indtil 70; der er fordele
- Den serendipitære opdagelse af en ny grøn kemimetode
- Hvilke funktioner er bevis for, at mange kontinenter på et tidspunkt var i nærheden af Jorden Sy…
- Hvorfor decarbonisering af søtransport måske ikke er problemfri
- Hvor er oliefelterne i indvendige sletter?


