Hvilke af følgende elementer er ikke et overgangsmetalelement mangankrom eller osmium?
Her er hvorfor:
* overgangsmetaller defineres som elementer, der har deres D -orbitaler delvist udfyldt i deres fælles oxidationstilstande.
* mangan (MN), chrom (CR) og osmium (OS) Alle falder inden for D-blokken i den periodiske tabel, og deres almindelige oxidationstilstande involverer delvist fyldte D-orbitaler.
* tin (Sn) er placeret i p-blokken på den periodiske tabel, hvilket betyder, at dens ydre elektroner optager P-orbitaler.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
 Nyt materiale tilbyder en miljøvenlig løsning til at omdanne spildvarme til energiKredit:Unsplash/CC0 Public Domain vedholdenhed, NASAs 2020 Mars rover, er drevet af noget meget ønskværdigt her på Jorden:en termoelektrisk enhed, som omdanner varme til nyttig elektricitet. På M
Nyt materiale tilbyder en miljøvenlig løsning til at omdanne spildvarme til energiKredit:Unsplash/CC0 Public Domain vedholdenhed, NASAs 2020 Mars rover, er drevet af noget meget ønskværdigt her på Jorden:en termoelektrisk enhed, som omdanner varme til nyttig elektricitet. På M -
 Computer redesigner enzymUniversitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysat
Computer redesigner enzymUniversitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysat -
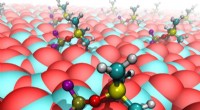 Videnskaben bag syltede batterielektrolytterHer er syltede elektrolytmolekyler (PF 2 OSiMe 3 ) binding til reaktionscentre på katodeoverfladen. For bold-og-stok-molekylerne, der er fastgjort til katodeoverfladen, olivengrøn angiver fosfor (
Videnskaben bag syltede batterielektrolytterHer er syltede elektrolytmolekyler (PF 2 OSiMe 3 ) binding til reaktionscentre på katodeoverfladen. For bold-og-stok-molekylerne, der er fastgjort til katodeoverfladen, olivengrøn angiver fosfor ( -
 En hurtig, effektiv COVID-19-biosensor er under udviklingRajesh Sardar, center, taler med Omolade Olofintuyi, venstre, en bachelor fra Howard University, som forskede i en avanceret biosensor for COVID-19 i sit laboratorium denne sommer gennem et NSF-finans
En hurtig, effektiv COVID-19-biosensor er under udviklingRajesh Sardar, center, taler med Omolade Olofintuyi, venstre, en bachelor fra Howard University, som forskede i en avanceret biosensor for COVID-19 i sit laboratorium denne sommer gennem et NSF-finans
- To-kuppel superledning i en kagome superleder opdaget under højt tryk
- Hvordan kan dele af Canada "mangle" tyngdekraften?
- Hvad er solens bane på grund af tyngdekraften?
- Opdelinger og fusioner:Undersøgelse af politiske uenigheders rolle ved partiskift ved hjælp af et …
- Migranters mentale sundhed kan afhænge af den måde, de bruger penge på, siger ny forskning
- Hvorfor kan du ikke tilføje fraktioner med i modsætning til nævner?


