Hvor mange antal ensomme par er elektroner i klor?
Her er hvorfor:
* klorens elektroniske konfiguration: Chlor har 17 elektroner med konfigurationen:1S² 2S² 2p⁶ 3S² 3P⁵
* Valenselektroner: Den yderste skal (3S² 3P⁵) har 7 elektroner, hvilket betyder, at klor har brug for en mere for at opnå en stabil oktet.
* binding: Klor danner typisk en kovalent binding, der deler et elektron med et andet atom. Dette efterlader 6 elektroner i sin yderste skal.
* Ensomme par: Disse 6 elektroner er arrangeret i tre par, der kaldes ensomme par.
Derfor har klor tre Enlige par elektroner.
 Varme artikler
Varme artikler
-
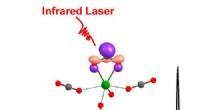 Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende
Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende -
 Forskere kan regne med forbedret proteomikmetodePrinceton Universitys Martin Wühr har forbedret sin metode til nøjagtigt at tælle de proteiner, der er til stede i en celle under forskellige omstændigheder. TMc+-metoden er i en slags sweet spot samm
Forskere kan regne med forbedret proteomikmetodePrinceton Universitys Martin Wühr har forbedret sin metode til nøjagtigt at tælle de proteiner, der er til stede i en celle under forskellige omstændigheder. TMc+-metoden er i en slags sweet spot samm -
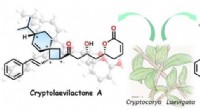 Australsk busk indeholder en ny klasse af organisk forbindelseIsolationer af unikke monoterpen-polyketider med spiro[3, 5]nonan fra C. laevigata . Kredit:Kanazawa University Den botaniske verden kan være et spændende sted for kemikere. Plantearter producer
Australsk busk indeholder en ny klasse af organisk forbindelseIsolationer af unikke monoterpen-polyketider med spiro[3, 5]nonan fra C. laevigata . Kredit:Kanazawa University Den botaniske verden kan være et spændende sted for kemikere. Plantearter producer -
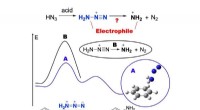 Kemikere beviser mekanismen for direkte aminering fra benzenDet grafiske abstrakt af direkte aminering. Kredit:Tomsk Polytechnic University (TPU) Et team af kemikere fra Tomsk Polytekniske Universitet opdagede en mekanisme for direkte elektrofil aminering
Kemikere beviser mekanismen for direkte aminering fra benzenDet grafiske abstrakt af direkte aminering. Kredit:Tomsk Polytechnic University (TPU) Et team af kemikere fra Tomsk Polytekniske Universitet opdagede en mekanisme for direkte elektrofil aminering
- Kvinder i rige lande får færre børn, eller slet ingen. Hvad sker der?
- Venteområdeunderholdning og samarbejde mellem fysiske butikker øger profitten
- Et probiotikum for vores lunger? Ny forskning stiller spørgsmål om fremtiden for behandling af COV…
- Hvad sker der med månen i løbet af dagen?
- Hvordan er radikale udtryk og rationelle eksponenter brugt i det virkelige liv?
- Discovery bringer termiske switches i nanoskala, der er nødvendige til næste generations computere


