Bliver en ændring i farve, der observeres, når kobber II -sulfatkrystaller bliver dehydreret, hvordan redegør du for, at vandet tilsættes til opvarmet sulfat?
Farveændringen
* hydreret kobber (II) sulfat: Når kobber (II) sulfat er hydreret (hvilket betyder, at det har vandmolekyler inkorporeret i sin krystalstruktur), har det en smuk blå farve. Dette skyldes, at vandmolekylerne koordineres til kobber (II) -ioner, hvilket forårsager et specifikt arrangement af elektroner, der absorberer visse bølgelængder af lys, hvilket resulterer i den blå farve.
* dehydreret kobber (II) sulfat: Når de opvarmes, køres vandmolekylerne af, hvilket efterlader vandfri kobber (II) sulfat. Denne form er en bleg hvid eller grålig-hvid. Tabet af vand forstyrrer arrangementet af elektroner omkring kobber (II) ioner, hvilket fører til en ændring i den måde, det interagerer med lys, hvilket ændrer farven.
Tilføjelse af vand tilbage
* rehydrering: Hvis du tilsætter vand til det dehydrerede kobber (II) sulfat, vil det let absorbere vandet tilbage i sin krystalstruktur. Denne proces er kendt som rehydrering. Når vandmolekylerne vender tilbage, gendannes koordineringen omkring kobber (II) -ionerne, og den blå farve dukker op igen.
Kortfattet:
* hydreret kobber (II) sulfat (cuso₄ • 5H₂O): Blå farve på grund af vand koordineret til kobberioner.
* dehydreret kobber (II) sulfat (cuso₄): Hvide eller gråhvide på grund af fraværet af vandmolekyler.
Denne farveændring er en visuel demonstration af, hvordan vand dramatisk kan påvirke et stofs udseende og kemiske egenskaber.
Sidste artikelEr en syre fizz, når den bliver neutral?
Næste artikelHvor mange fluoratomer er der i 65 g CF4?
 Varme artikler
Varme artikler
-
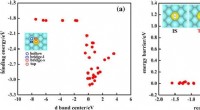 AI ledte efter enkeltatom-legeringskatalysatorer, fundet 200 lovende kandidaterFig. 1:Korrelation mellem simple deskriptorer og målegenskaber. Skoltech-forskere og deres kolleger fra Kina og Tyskland har præsenteret en ny søgealgoritme efter single-atom-legeringskatalysatore
AI ledte efter enkeltatom-legeringskatalysatorer, fundet 200 lovende kandidaterFig. 1:Korrelation mellem simple deskriptorer og målegenskaber. Skoltech-forskere og deres kolleger fra Kina og Tyskland har præsenteret en ny søgealgoritme efter single-atom-legeringskatalysatore -
 Forskere udvikler 3D-printet formhukommelseslegering med overlegen superelasticitetEt elektronmikrografi af nikkel-titanium-pulver er vist til venstre. Forskerne kan bruge dette pulver til at fremstille 3D-printede dele, såsom nikkel-titanium-gitre (til højre). Kredit:Texas A&M Engi
Forskere udvikler 3D-printet formhukommelseslegering med overlegen superelasticitetEt elektronmikrografi af nikkel-titanium-pulver er vist til venstre. Forskerne kan bruge dette pulver til at fremstille 3D-printede dele, såsom nikkel-titanium-gitre (til højre). Kredit:Texas A&M Engi -
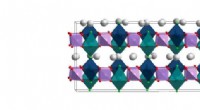 Ny genomisk metode afslører atomarrangementer af batterimaterialeLavtemperaturstrukturen af NVPF [Na3V2(PO4)2F3] løst i dette arbejde. Beregninger fra Lawrence Berkeley National Laboratory tyder på, at natriumatomerne (hvide) lettest kan bevæge sig i flyene melle
Ny genomisk metode afslører atomarrangementer af batterimaterialeLavtemperaturstrukturen af NVPF [Na3V2(PO4)2F3] løst i dette arbejde. Beregninger fra Lawrence Berkeley National Laboratory tyder på, at natriumatomerne (hvide) lettest kan bevæge sig i flyene melle -
 Illinois ingeniør fortsætter med at lave bølger i vandafsaltningAdjunkt Kyle Smith. Kredit:University of Illinois. I de sidste mange år, University of Illinois-forsker Kyle Smith har bevist sin voksende ekspertise inden for vandafsaltning, med en række forskni
Illinois ingeniør fortsætter med at lave bølger i vandafsaltningAdjunkt Kyle Smith. Kredit:University of Illinois. I de sidste mange år, University of Illinois-forsker Kyle Smith har bevist sin voksende ekspertise inden for vandafsaltning, med en række forskni
- AIs indflydelse på FN-mål for klima, udvikling og global stabilitet analyseres for første gang
- Hvordan måles en biologisk produktivitet?
- Forskere udvikler en ny metode til at forbedre politiets opstillinger
- Billig, ikke-toksiske kulstofnanodotter, der er klar til at være fremtidens kvanteprikker
- Hvilket gasformigt materiale kan føres ind i atmosfæren?
- Hvad er rate i fysik?


