Hvad er formlen for anden forbindelse, hvis to oxider et metal indeholder henholdsvis 27,6 procent og 30 ilt først M3O4?
forståelse af problemet
Vi har to metaloxider. Det første oxid har formlen m₃o₄, hvor m repræsenterer metallet. Vi kender procentdelen af ilt i begge oxider. Vi er nødt til at finde formlen for det andet oxid.
trin
1. Bestem metalens molære masse i det første oxid:
* Lad den molære masse af metallet (m) være 'x'.
* Den molære masse af m₃o₄ =3x + (4 * 16) =3x + 64
* Procentdel af ilt i m₃o₄ =(64 / (3x + 64)) * 100 =27.6
* Løs for 'X':6400 =82,8x + 1769.6
* 4630.4 =82.8x
* x ≈ 55.8
2. Bestem den empiriske formel for den anden oxid:
* Det andet oxid indeholder 30% ilt efter masse.
* Dette betyder, at hvis vi antager en 100 g prøve, er der 30 g ilt og 70 g af metallet.
* Konverter gram til mol:
* Mol ilt =30g / 16g / mol =1,875 mol
* Mol metal =70 g / 55,8 g / mol ≈ 1,25 mol
* Opdel molen for hvert element med det mindste antal mol for at finde det enkleste forhold mellem hele tal:
* O:1.875 / 1.25 =1.5
* M:1,25 / 1,25 =1
* Da vi ikke kan have fraktionerede underskrifter, skal du multiplicere begge med 2 for at få hele tal:
* O:3
* M:2
Formlen for det andet oxid
Formlen for det andet oxid er m₂o₃ .
 Varme artikler
Varme artikler
-
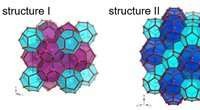 Neutroner afslører hurtig metan -translationel diffusion ved grænsefladen mellem to klathratstrukt…Enhedsceller af clathratstruktur I og clathrate -struktur II. Forskellige typer polyhedrale bure er repræsenteret i forskellige farver. Kredit:Ranieri et al., Nature Comm . Gasclathrat-hydrater
Neutroner afslører hurtig metan -translationel diffusion ved grænsefladen mellem to klathratstrukt…Enhedsceller af clathratstruktur I og clathrate -struktur II. Forskellige typer polyhedrale bure er repræsenteret i forskellige farver. Kredit:Ranieri et al., Nature Comm . Gasclathrat-hydrater -
 Undersøgelse fremskynder omdannelsen af biobrændstofaffald til nyttige kemikalierSandia National Laboratories bioingeniør Seema Singh undersøger en tobaksplante, der er blevet gensplejset til nem udvinding af vigtige kemikalier. Kredit:Dino Vournas Et team ledet af Sandia Nati
Undersøgelse fremskynder omdannelsen af biobrændstofaffald til nyttige kemikalierSandia National Laboratories bioingeniør Seema Singh undersøger en tobaksplante, der er blevet gensplejset til nem udvinding af vigtige kemikalier. Kredit:Dino Vournas Et team ledet af Sandia Nati -
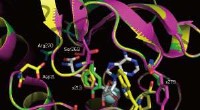 Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnoseEt nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim Org
Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnoseEt nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim Org -
 3-D-printede krukker i kuglefræsningseksperimenterTyndvægget krukke med en rille; isometrisk billede med et snit (venstre) og tværsnit (højre). Kredit:Tumanov et al Mekanokemi er en udbredt synteseteknik inden for alle områder af kemi. Forskellig
3-D-printede krukker i kuglefræsningseksperimenterTyndvægget krukke med en rille; isometrisk billede med et snit (venstre) og tværsnit (højre). Kredit:Tumanov et al Mekanokemi er en udbredt synteseteknik inden for alle områder af kemi. Forskellig
- Sprængende pulsar blev opdaget at hikke i den afgørende fase af dens livscyklus
- Hvordan vibrerer mediet i en tværgående bølge med to gange energikraft, der leveres i rette vinkl…
- Har klimaskeptikere ret?
- Ny forskning finder måder at forbedre nøjagtigheden af laterale flowtest
- Skift fra blå til rød for bedre lysdioder
- En neandertaler fra Chagyrskaya-hulen


