Tiltrækker klor af frigørelseselektron, og i bekræftende fald hvor mange er involveret?
* Elektronegativitet: Klor er meget elektronegativ, hvilket betyder, at det har en stærk tendens til at tiltrække elektroner mod sig selv. Dette skyldes sin position på den periodiske tabel.
* Elektronkonfiguration: Chlor har 7 elektroner i sin yderste skal, og den ønsker at opnå en stabil octet (8 elektroner) konfiguration. Ved at få en elektron kan det opnå denne stabile tilstand.
Hvor mange elektroner?
Klor typisk får en elektron at danne en chloridion (Cl-). Dette skyldes, at det at få en elektron afslutter sin yderste skal og gør den mere stabil.
Eksempel: Når klor reagerer med natrium (NA), mister natrium et elektron for at blive Na+ og chlorgevinster, som elektronet bliver CL-. Dette danner den ioniske forbindelse natriumchlorid (NaCI).
 Varme artikler
Varme artikler
-
 Forlængelse af fødevarers holdbarhed med nanomaterialerKredit:Ozgur Coskun, Shutterstock Hvornår var sidste gang du blev fristet af lækre kirsebær i dit supermarked eller så, at dit yndlingsmærke af emballeret brød var til salg, og du har grådigt købt
Forlængelse af fødevarers holdbarhed med nanomaterialerKredit:Ozgur Coskun, Shutterstock Hvornår var sidste gang du blev fristet af lækre kirsebær i dit supermarked eller så, at dit yndlingsmærke af emballeret brød var til salg, og du har grådigt købt -
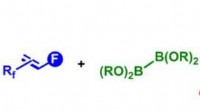 Kemikere frigør potentialet for fluoralkenerSyntesevej til forskellige fluoralkener via defluorborylering af polyfluoralkener. Kredit:© 2017 Osaka University, RIKEN, og Tokyo Medical and Dental University En af de stærkeste kemiske bindinge
Kemikere frigør potentialet for fluoralkenerSyntesevej til forskellige fluoralkener via defluorborylering af polyfluoralkener. Kredit:© 2017 Osaka University, RIKEN, og Tokyo Medical and Dental University En af de stærkeste kemiske bindinge -
 Nyt materiale til at overgå traditionelle oxygenreduktionsreaktionskatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. YANG Minghui ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) opdagede, at
Nyt materiale til at overgå traditionelle oxygenreduktionsreaktionskatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. YANG Minghui ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) opdagede, at -
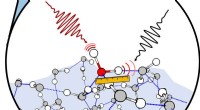 Kemikere ser nærmere på stedet, hvor vand møder luftSkematisk vandoverflade, hvor den spektrale signatur af et isotopisk mærket vandmolekyle er isoleret med to infrarøde lasere. Kredit:Nan Yang Vand, på trods af dens centrale plads i så mange proce
Kemikere ser nærmere på stedet, hvor vand møder luftSkematisk vandoverflade, hvor den spektrale signatur af et isotopisk mærket vandmolekyle er isoleret med to infrarøde lasere. Kredit:Nan Yang Vand, på trods af dens centrale plads i så mange proce


