Hvorfor har kaliumchlorid et højt smeltepunkt?
* ionisk binding: KCL er en ionisk forbindelse, hvilket betyder, at den dannes af den elektrostatiske tiltrækning mellem positivt ladede kaliumioner (K+) og negativt ladede chloridioner (CL-). Disse modsatte afgifter skaber en stærk obligation.
* gitterstruktur: Disse ioner arrangerer sig selv i en meget ordnet, tredimensionel krystalgitter. Denne struktur maksimerer de attraktive kræfter mellem ioner, hvilket gør den meget stabil.
* Høj energi krævet: For at smelte KCL skal du overvinde disse stærke elektrostatiske attraktioner og forstyrre krystalgitteret. Dette kræver en betydelig mængde energi, og dermed det høje smeltepunkt.
Her er grunden til, at andre faktorer bidrager til KCLs høje smeltepunkt:
* lille ionstørrelse: Både kalium- og chloridioner er relativt små. Dette muliggør tættere nærhed mellem ioner i gitteret, hvilket yderligere forbedrer den elektrostatiske attraktion.
* Høj opladningstæthed: +1 ladningen på kalium og -1 ladning på chlorid skaber en høj ladningstæthed. Dette styrker yderligere de elektrostatiske kræfter, der holder gitteret sammen.
Til sammenligning:
* kovalente forbindelser: De har svagere intermolekylære kræfter, hvilket fører til lavere smeltepunkter.
* Metalliske forbindelser: De har et "hav af elektroner", der giver mulighed for større mobilitet og lavere smeltepunkter end ioniske forbindelser.
generelt: Kombinationen af stærk ionisk binding, en stabil krystalgitter og egenskaberne ved kalium- og chloridioner bidrager til det høje smeltepunkt for kaliumchlorid.
 Varme artikler
Varme artikler
-
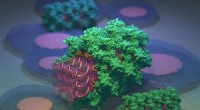 DNA nanostrukturer bliver camoufleret af proteinerDNA-nanostrukturer (lilla) bliver camoufleret af serumalbuminproteiner (grøn). Kredit:Veikko Linko og Mauri Kostiainen Forskere fra Aalto University og Helsinki University har rapporteret en strat
DNA nanostrukturer bliver camoufleret af proteinerDNA-nanostrukturer (lilla) bliver camoufleret af serumalbuminproteiner (grøn). Kredit:Veikko Linko og Mauri Kostiainen Forskere fra Aalto University og Helsinki University har rapporteret en strat -
 Kunstigt farveskiftende materiale, der efterligner kamæleonhud, kan registrere frisk fisk og skaldy…Farveskiftet på den kameleonhud hydrogelbaserede kemosensor som reaktion på biogene flygtige amindampe, som er en velkendt indikator for ødelæggelse af fisk og rejer. Kredit:Lu et al./Cell Reports Phy
Kunstigt farveskiftende materiale, der efterligner kamæleonhud, kan registrere frisk fisk og skaldy…Farveskiftet på den kameleonhud hydrogelbaserede kemosensor som reaktion på biogene flygtige amindampe, som er en velkendt indikator for ødelæggelse af fisk og rejer. Kredit:Lu et al./Cell Reports Phy -
 Video:Hvorfor ændrer salt smagen af alting?Kredit:The American Chemical Society Hvis din kaffe er for bitter, tilsæt en knivspids salt. Hvis din salat ikke er sur nok, tilsæt et nip salt. Hvis din øl er for bitter, tilsæt en knivspids salt.
Video:Hvorfor ændrer salt smagen af alting?Kredit:The American Chemical Society Hvis din kaffe er for bitter, tilsæt en knivspids salt. Hvis din salat ikke er sur nok, tilsæt et nip salt. Hvis din øl er for bitter, tilsæt en knivspids salt. -
 Gigt, opdagelse af autoimmun sygdom kan føre til nye behandlingerHubert Yin i sit laboratorium på BioFrontiers Institute. Kredit:Glenn Asakawa/CU Boulder Mere end 23,5 millioner amerikanere lider af autoimmune sygdomme som reumatoid arthritis, sklerodermi og lu
Gigt, opdagelse af autoimmun sygdom kan føre til nye behandlingerHubert Yin i sit laboratorium på BioFrontiers Institute. Kredit:Glenn Asakawa/CU Boulder Mere end 23,5 millioner amerikanere lider af autoimmune sygdomme som reumatoid arthritis, sklerodermi og lu
- Papir uden mikroplast:En økonomisk og miljøvenlig belægning
- Undersøgelse viser, hvordan genhandling kan føre til diabetesforebyggelse, helbredelse
- Hvad de lokale spiste for 10.000 år siden
- Hvordan celler forsvarer sig mod antibiotika og cytostatika
- Arkæologer fejrer den spektakulære opdagelse af jernalderens skatte
- Grækenland skovbrande:Hvordan klimaændringer er involveret, og hvad vi kan gøre ved det


