Latent varme med hensyn til molekylær opførsel?
Latent varme:Et molekylært perspektiv
Latent varme, den energi, der er absorberet eller frigivet under en tilstandsskift (som smeltning, frysning, kogning eller kondensering) uden temperaturændring, kan forklares smukt ved at overveje den molekylære opførsel:
1. Molekylære interaktioner:
* fast: I en fast tilstand er molekyler tæt pakket og holdes sammen af stærke intermolekylære kræfter (som ioniske bindinger, kovalente bindinger eller brintbindinger). Disse kræfter begrænser molekylernes bevægelse og holder dem i en fast, stiv struktur.
* væske: I en flydende tilstand er molekyler stadig tæt på hinanden, men har mere frihed til at bevæge sig rundt og ændre positioner. De intermolekylære kræfter er svagere end i faste stoffer, hvilket muliggør fluiditet.
* gas: I en gasformig tilstand er molekyler bredt adskilt og bevæger sig frit og interagerer kun kort under kollisioner. De intermolekylære kræfter er meget svage.
2. Energiindgang og molekylær bevægelse:
* smeltning: At tilføje varmeenergi til en fast stof giver energi til at bryde de intermolekylære kræfter, der holder molekylerne i en fast position. Denne energi øger vibration og bevægelse af molekylerne, hvilket til sidst giver dem mulighed for at overvinde begrænsningerne og overgangen til en flydende tilstand.
* Frysning: Fjernelse af varmeenergi fra en flydende reducerer molekylernes kinetiske energi. Dette svækker deres bevægelse og giver de intermolekylære kræfter mulighed for at trække molekylerne tættere sammen og danne et fast stof.
* kogning: Tilsætning af varmeenergi til en væske giver nok energi til at overvinde de resterende intermolekylære kræfter, hvilket giver molekyler mulighed for at undslippe den flydende overflade og komme ind i den gasformige tilstand. Dette er fordampningsprocessen.
* kondens: Fjernelse af varmeenergi fra en gas reducerer molekylernes kinetiske energi, hvilket gør det muligt for intermolekylære kræfter at trække dem nærmere og danne en væske.
3. Latent varme:Energien til at bryde eller danne bindinger:
* Den energi, der er absorberet eller frigivet under en tilstandsskift, bruges ikke til at øge temperaturen (molekylær kinetisk energi), men snarere til at overvinde eller etablere intermolekylære kræfter. Denne energi er kendt som latent varme.
* latent fusionsvarme: Dette er den energi, der kræves for at bryde bindingerne mellem molekyler i et fast stof for at omdanne den til en væske.
* Latent fordampningsvarme: Dette er den energi, der kræves for at overvinde de intermolekylære kræfter, der holder molekylerne i en flydende tilstand, så de kan flygte ind i den gasformige fase.
Sammenfattende kan latent varme forstås som den energi, der er nødvendig for at ændre molekylærarrangementet og styrken af intermolekylære kræfter mellem molekyler under en tilstandsskift. Denne energi er ikke relateret til temperatur, hvilket afspejler molekylernes gennemsnitlige kinetiske energi.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af en bestemt tilstandsændring eller vil gerne have eksempler på, hvordan latent varme påvirker vores hverdag!
 Varme artikler
Varme artikler
-
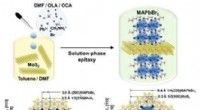 Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef
Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef -
 Panel til at offentliggøre 2020 Nobelprisen i kemiI denne 17. april, 2015, fil foto, en nationalbiblioteksmedarbejder viser en guld nobelprismedalje i Bogota, Colombia. Nobelerne, med nye vindere annonceret fra mandag d. 5. okt. 2020, koncentrerer si
Panel til at offentliggøre 2020 Nobelprisen i kemiI denne 17. april, 2015, fil foto, en nationalbiblioteksmedarbejder viser en guld nobelprismedalje i Bogota, Colombia. Nobelerne, med nye vindere annonceret fra mandag d. 5. okt. 2020, koncentrerer si -
 Stikkende smagsstof i ingefær reducerer dårlig åndeKredit:CC0 Public Domain Den skarpe forbindelse 6-gingerol, en bestanddel af ingefær, stimulerer et enzym i spyt, der nedbryder ildelugtende stoffer. Det sikrer dermed frisk ånde og en bedre efter
Stikkende smagsstof i ingefær reducerer dårlig åndeKredit:CC0 Public Domain Den skarpe forbindelse 6-gingerol, en bestanddel af ingefær, stimulerer et enzym i spyt, der nedbryder ildelugtende stoffer. Det sikrer dermed frisk ånde og en bedre efter -
 Forskere producerer et farveløst reservoir af platinmetallignende enkeltatomer i væskeSkematisk illustration af (R1OR2)2Pt(0)Cl2H2. Kredit:DICP Understøttede enkeltmetalatomer har tiltrukket bred interesse for deres demonstrerede høje effektivitet i enkeltmetalkatalyse. Fremstillin
Forskere producerer et farveløst reservoir af platinmetallignende enkeltatomer i væskeSkematisk illustration af (R1OR2)2Pt(0)Cl2H2. Kredit:DICP Understøttede enkeltmetalatomer har tiltrukket bred interesse for deres demonstrerede høje effektivitet i enkeltmetalkatalyse. Fremstillin
- Hvorfor bruger videnskabsmand videnskabelig metode?
- Kemikere designer nanopartikler, der kan levere tre kræftlægemidler ad gangen
- Smarte byer:Løfter og fiaskoer i utopisk teknologisk planlægning
- 5, 000 Dieselgate-dødsfald i Europa om året:undersøgelse
- Stier, hvor genstande rejser rundt om solen?
- Hvilket kendt stof holder varme bedst?


