Hvorfor er gasser mere i stand til at gennemgå termisk ekspansion end liuider og faste stoffer?
* svage intermolekylære kræfter: I gasser er de attraktive kræfter mellem molekyler meget svage. Dette gør det muligt for molekyler at bevæge sig frit og uafhængigt uden at være stærkt bundet til hinanden.
* Store afstande: Molekylerne i en gas er langt længere fra hinanden end i væsker eller faste stoffer. Dette betyder, at der er mere tom plads for molekylerne at sprede sig, når de opvarmes.
hvordan dette påvirker termisk ekspansion:
* Når du opvarmer en gas, absorberer molekylerne energi og bevæger sig hurtigere. Denne øgede kinetiske energi får dem til at kollidere med hinanden og væggene i deres beholder oftere og med større kraft.
* På grund af de svage kræfter og store afstande, kan molekylerne let sprede sig, hvilket fører til en betydelig stigning i volumen.
I modsætning hertil:væsker og faste stoffer:
* væsker: Har stærkere intermolekylære kræfter end gasser, og hold molekyler tættere sammen. Mens de kan bevæge sig forbi hinanden, begrænser den begrænsede plads udvidelse.
* faste stoffer: Har de stærkeste intermolekylære kræfter, der holder molekyler i faste positioner. Denne stive struktur begrænser ekspansionen til meget små ændringer i volumen.
Derfor er gasser de mest komprimerbare og udvidelige stoftilstande på grund af deres svage intermolekylære kræfter og store intermolekylære afstande.
Sidste artikelHvorfor bruges CO2 -gas til MiG -svejsning?
Næste artikelLatent varme med hensyn til molekylær opførsel?
 Varme artikler
Varme artikler
-
 Elektronbevægelser i væske målt i super-slowmotionForskerne sprøjter vand fra oven ind i analysekammeret, hvor den danner en kort mikrojet, der møder en laserstråle. Kredit:ETH Zürich / Inga Jordan Elektroner er i stand til at bevæge sig inden fo
Elektronbevægelser i væske målt i super-slowmotionForskerne sprøjter vand fra oven ind i analysekammeret, hvor den danner en kort mikrojet, der møder en laserstråle. Kredit:ETH Zürich / Inga Jordan Elektroner er i stand til at bevæge sig inden fo -
 Kemikere udvikler kontaminantdetekteringsteknik for heparinJason Dwyer, lektor i kemi, taler med James Hagan, fra Nashua, N.H., en doktorand i Dwyers forskningsgruppe, og gymnasieelev Anna Khabaeva, fra Cranston, der er på et forskningsstipendium. Kredit:Mich
Kemikere udvikler kontaminantdetekteringsteknik for heparinJason Dwyer, lektor i kemi, taler med James Hagan, fra Nashua, N.H., en doktorand i Dwyers forskningsgruppe, og gymnasieelev Anna Khabaeva, fra Cranston, der er på et forskningsstipendium. Kredit:Mich -
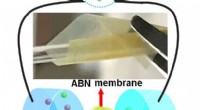 Membran inspireret af knogler og brusk producerer effektivt elektricitet fra saltvandDette diagram viser bio-inspirerede nanokompositmembraner til effektiv høst af blå energi. Kredit:Chen et al. Inspireret af membraner i levende organismers kropsvæv, forskere har kombineret aramid
Membran inspireret af knogler og brusk producerer effektivt elektricitet fra saltvandDette diagram viser bio-inspirerede nanokompositmembraner til effektiv høst af blå energi. Kredit:Chen et al. Inspireret af membraner i levende organismers kropsvæv, forskere har kombineret aramid -
 Discovery lyser vej til Alzheimers -forskningEt rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemidde
Discovery lyser vej til Alzheimers -forskningEt rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemidde


