Hvilken af orbitalen, nemlig 1p2s2p og 3f, er ikke mulige give grund til dit svar?
1. 1p:
* hovedkantenummer (n): '1' i 1p indikerer det vigtigste kvantetal, der beskriver elektronens energiniveau. N =1 svarer til det første energiniveau.
* vinkelmomentumnummer (L): 'P' angiver vinkelmomentumnummeret, der beskriver formen på orbitalen. For p orbitaler, L =1.
* Problemet: De tilladte værdier for L er begrænset af n. Den maksimale værdi af L er n - 1. siden n =1, den maksimale værdi af L skal være 0, svarende til en S -orbital. Derfor er en 1p orbital ikke mulig.
2. 2S2P:
* Dette er ikke en eneste orbital. Denne notation indebærer to orbitaler, en 2S og en 2p. Mens begge er gyldige orbitaler, kan de ikke kombineres til en enkelt "2S2P" orbital.
3. 3f:
* hovedkantenummer (n): '3' i 3F indikerer n =3, hvilket betyder det tredje energiniveau.
* vinkelmomentumnummer (L): 'F' angiver L =3.
* Problemet: For n =3 er de tilladte værdier for L henholdsvis 0, 1 og 2 svarende til henholdsvis S-, P- og D -orbitaler. En 3F orbital (L =3) ville kræve, at N er mindst 4.
Kortfattet: Orbitalerne 1p, 2S2P og 3F er ikke mulige på grund af de begrænsninger, der er pålagt af kvantetalene, der beskriver elektron -orbitaler.
Sidste artikelLatent varme med hensyn til molekylær opførsel?
Næste artikelHvad er elektroner en del af?
 Varme artikler
Varme artikler
-
 Undersøgelse udvider, hvad vi ved om naturlige, billige måder at fjerne forurenende stoffer fra va…Inden for timer, tørrede og malede avocadoskaller hjælper med at fjerne methylenblåt farvestof fra vand gennem en proces, der kaldes adsorption. Kredit:Dickinson College Nypubliceret forskning fra
Undersøgelse udvider, hvad vi ved om naturlige, billige måder at fjerne forurenende stoffer fra va…Inden for timer, tørrede og malede avocadoskaller hjælper med at fjerne methylenblåt farvestof fra vand gennem en proces, der kaldes adsorption. Kredit:Dickinson College Nypubliceret forskning fra -
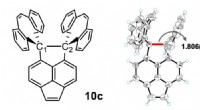 Ny rekord sat for carbon-carbon enkeltbindingslængdeDen kemiske struktur af forbindelsen, som viste den længste C-C-binding. Kredit:Ishigaki Y. et al., Chem , 8. marts, 2018. Forskere fra Hokkaido University har syntetiseret en organisk forbindel
Ny rekord sat for carbon-carbon enkeltbindingslængdeDen kemiske struktur af forbindelsen, som viste den længste C-C-binding. Kredit:Ishigaki Y. et al., Chem , 8. marts, 2018. Forskere fra Hokkaido University har syntetiseret en organisk forbindel -
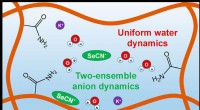 Hydrogeler ændrer vand og opløste stoffers dynamikPolymerfibre (brune) danner porer i polyacrylamid -hydrogeler. Inde i en af disse små porer, vandmolekyler (røde og hvide strukturer) udviser en ensartet adfærd, uanset hvor de tilfældigvis er place
Hydrogeler ændrer vand og opløste stoffers dynamikPolymerfibre (brune) danner porer i polyacrylamid -hydrogeler. Inde i en af disse små porer, vandmolekyler (røde og hvide strukturer) udviser en ensartet adfærd, uanset hvor de tilfældigvis er place -
 Undgå madforurening med en holdbar belægning til hårde overfladerEn ny undersøgelse fra University of Missouri viser, at en holdbar belægning - fremstillet af titandioxid - er i stand til at fjerne fødevarebårne bakterier, såsom salmonella og E. coli, og giver et f
Undgå madforurening med en holdbar belægning til hårde overfladerEn ny undersøgelse fra University of Missouri viser, at en holdbar belægning - fremstillet af titandioxid - er i stand til at fjerne fødevarebårne bakterier, såsom salmonella og E. coli, og giver et f
- Hvilke energitransformationer forekommer, hvis den endelige form af IS -varme fra en elektrisk komfu…
- Hvornår er det dagslys besparelser EDT?
- Hvad er den mest koncentrerede energikilde?
- Hvordan lander raketten på jorden?
- Hvad er navnet på benzen med en NH2-gruppe?
- Overvågning af den arktiske hedebølge


