Et kilogram gas har et meget større volumen end 1 fast anvendelse kinetisk teori til at forklare hvorfor?
kinetisk teori om stof
* Gasser: Gaspartikler er vidt placeret, bevæger sig hurtigt og tilfældigt og har meget svage attraktive kræfter mellem dem. De kolliderer konstant med hinanden og væggene i deres beholder og skaber pres.
* faste stoffer: Faste partikler er tæt pakket sammen, vibrerer i faste positioner og har stærke attraktive kræfter. De opretholder en bestemt form og volumen.
Forskellen i volumen
1. afstand: Den vigtigste forskel er afstanden mellem partikler. Gaspartikler har meget større afstand end faste partikler. Forestil dig et klasseværelse fuld af studerende (solid) versus et stort udendørs felt med det samme antal mennesker spredt (gas).
2. kinetisk energi: Gaspartikler har markant mere kinetisk energi end faste partikler. Dette betyder, at de bevæger sig hurtigere og kolliderer oftere, hvilket yderligere øger afstanden mellem dem.
3. attraktive kræfter: De svage attraktive kræfter mellem gaspartikler giver dem mulighed for at bevæge sig frit og udvide for at fylde deres beholder. I modsætning hertil holder de stærke attraktive kræfter i faste stoffer partiklerne tæt bundet sammen.
Kortfattet
Det store volumen af et kilogram gas sammenlignet med et kg fast stof er direkte relateret til den meget større afstand mellem gaspartikler, deres høje kinetiske energi og svage attraktive kræfter. Disse faktorer tillader gaspartikler at bevæge sig frit og optager et meget større volumen end de tætpakkede partikler i et fast stof.
 Varme artikler
Varme artikler
-
 Kemikere opdager ny reaktivitet af anstrengte molekylerMünster-teamet bruger denne laboratorieopsætning til at udføre fotocykloaddition. Kredit:University of Münster - Roman Kleinmans I syntetisk organisk kemi er såkaldte cycloadditioner en særlig vigt
Kemikere opdager ny reaktivitet af anstrengte molekylerMünster-teamet bruger denne laboratorieopsætning til at udføre fotocykloaddition. Kredit:University of Münster - Roman Kleinmans I syntetisk organisk kemi er såkaldte cycloadditioner en særlig vigt -
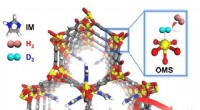 Udvikling af smart isotopadskillelsessystemMOF-74-IM. Kredit:UNIST Et internationalt team af forskere, tilknyttet UNIST har præsenteret et nyt hydrogenisotopseparationssystem baseret på et porøst metal organisk rammeværk (MOF). Isoleringen
Udvikling af smart isotopadskillelsessystemMOF-74-IM. Kredit:UNIST Et internationalt team af forskere, tilknyttet UNIST har præsenteret et nyt hydrogenisotopseparationssystem baseret på et porøst metal organisk rammeværk (MOF). Isoleringen -
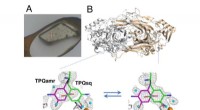 Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat
Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat -
 Forskere udvikler teknologi til at fange tumorcellerLeidong Mao, venstre, med eleverne Sam Arsenault og Zhaojie Deng i et rent laboratorium sammenkrøbet ved siden af en bio-inkubator, der bruges til at dyrke kræftceller, som Mao bruger i sin forsknin
Forskere udvikler teknologi til at fange tumorcellerLeidong Mao, venstre, med eleverne Sam Arsenault og Zhaojie Deng i et rent laboratorium sammenkrøbet ved siden af en bio-inkubator, der bruges til at dyrke kræftceller, som Mao bruger i sin forsknin
- Hvad sker der, hvis du blander jernsulfat og natriumhydroxid?
- En hundrede tusind gange forbedring af siliciums ikke-linearitet
- Hvem navngav Supernova -stjernen?
- Amazon forbedrer ansigtsanalyse -teknologi, tilføjer frygt
- Hvad er sandt med energi, og hvor lys omdannes til varme, såsom når en varmer op?
- Brug af Jordens historie til at informere om søgen efter liv på exoplaneter


