Hvad er den typiske de broglie -bølgelængde af et iltmolekyle ved stuetemperatur?
1. Forstå de broglie bølgelængde
De Broglie -bølgelængden (λ) af en partikel er relateret til dens momentum (P) af følgende ligning:
λ =h/p
Hvor:
* λ er de broglie bølgelængde
* H er Planck's Constant (6.626 x 10⁻³⁴ JS)
* P er momentumet
2. Beregn momentum
Momentumet af en partikel er givet af:
p =mv
Hvor:
* m er massen af partiklen
* V er partikelens hastighed
For at finde hastigheden bruger vi begrebet den gennemsnitlige kinetiske energi i et gasmolekyle ved en given temperatur.
3. Beregn gennemsnitlig kinetisk energi
Den gennemsnitlige kinetiske energi (KE) af et gasmolekyle er relateret til temperaturen (t) af følgende ligning:
Ke =(3/2) Kt
Hvor:
* K er Boltzmanns konstant (1,38 x 10 ²³ J/K)
* T er temperaturen i Kelvin
4. Beregn hastighed
Da kinetisk energi også er givet af KE =(1/2) mv², kan vi kombinere dette med den gennemsnitlige kinetiske energiligning for at finde hastigheden:
(1/2) mv² =(3/2) kt
v² =(3kt)/m
v =√ ((3kt)/m)
5. Tilslut værdierne
* masse af et iltmolekyle (O₂): 32 g/mol =32 x 10⁻³ kg/mol. Vi har brug for massen i kg, så del med Avogadros nummer (6,022 x 10²³ molekyler/mol):m ≈ 5,31 x 10⁻²⁶ kg
* stuetemperatur: 25 ° C =298 K
Beregn nu hastigheden:
v =√ ((3 * 1,38 x 10⁻²³ J/K * 298 K)/(5,31 x 10⁻²⁶ kg)) ≈ 482 m/s
6. Beregn de broglie bølgelængde
Endelig beregnes de Broglie -bølgelængden:
λ =h/p =h/(mv) =(6,626 x 10⁻³⁴ js)/(5,31 x 10⁻²⁶ kg * 482 m/s) ≈ 2,6 x 10⁻¹¹ M
Konklusion
Den typiske de broglie -bølgelængde af et iltmolekyle ved stuetemperatur er ca. 2,6 x 10⁻¹¹ meter, hvilket er ca. 0,26 angstromer. Denne bølgelængde er meget mindre end den typiske størrelse af et atom, der er i størrelsesordenen 1 Angstrom.
 Varme artikler
Varme artikler
-
 Hvorfor har vi brug for sletbare MR-scanningerCaltechs Mikhail Shapiro og hans kolleger har udviklet sletbare MR -kontrastmidler, der kan blinke ved kommando med ultralydsteknologi. Som illustreret her, kontrastmidlerne – som består af luftfyldte
Hvorfor har vi brug for sletbare MR-scanningerCaltechs Mikhail Shapiro og hans kolleger har udviklet sletbare MR -kontrastmidler, der kan blinke ved kommando med ultralydsteknologi. Som illustreret her, kontrastmidlerne – som består af luftfyldte -
 Designer enzym erobrer sulfitreduktion, en flaskehals i miljøoprydningKemiprofessor Yi Lu, venstre, og kandidatstuderende Evan Mirts har designet et nyt syntetisk enzym, der reducerer forbindelsen sulfit til sulfid - en notorisk kompleks flertrins kemisk reaktion, der h
Designer enzym erobrer sulfitreduktion, en flaskehals i miljøoprydningKemiprofessor Yi Lu, venstre, og kandidatstuderende Evan Mirts har designet et nyt syntetisk enzym, der reducerer forbindelsen sulfit til sulfid - en notorisk kompleks flertrins kemisk reaktion, der h -
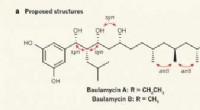 Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle -
 Komposterbart biolæder tilbyder bæredygtige løsninger til tøjindustrien og videreMikrobiel biofabrikation og grøn forarbejdning inspireret af kulturarv tilbyder en vej til en cirkulær materialeøkonomi. Kredit:Theanne Schiros/Columbia Engineering og FIT Siden begyndelsen af de
Komposterbart biolæder tilbyder bæredygtige løsninger til tøjindustrien og videreMikrobiel biofabrikation og grøn forarbejdning inspireret af kulturarv tilbyder en vej til en cirkulær materialeøkonomi. Kredit:Theanne Schiros/Columbia Engineering og FIT Siden begyndelsen af de
- Hav- og rumudforskning blandes på URIs Graduate School of Oceanography
- Hvem opfandt toilettet?
- BMW-fortjenesten er påvirket af investeringsomkostninger i elbiler
- Hvordan vi træffer moralske beslutninger
- Hvad er fire ikke-levende ting i et ørkenøkosystem?
- Vil præ-pandemisk kontorliv nogensinde få et comeback?


