Er molekyler inde i det faste stationære eller i en kontinuerlig bevægelse?
Her er hvorfor:
* vibrationsbevægelse: Molekylerne i en solid vibrerer frem og tilbage omkring faste positioner. Disse vibrationer er meget hurtige, selv ved stuetemperatur.
* begrænset translationel bevægelse: Mens molekyler i faste stoffer ikke kan bevæge sig frit som i væsker eller gasser, udviser de en meget lille mængde translationel bevægelse. Dette betyder, at de lidt kan flytte deres positioner, skønt de forbliver stort set begrænset til deres gitterstruktur.
* Temperatur og bevægelse: Mængden af vibrations- og translationsbevægelse stiger med temperaturen. Dette er grunden til, at faste stoffer udvides, når det opvarmes - den øgede bevægelse fører til større afstand mellem molekyler.
Så mens molekyler i et fast stof ikke "løber rundt" som i en gas, er de stadig i konstant bevægelse, omend en meget mere begrænset og begrænset bevægelse sammenlignet med andre stofstater.
Sidste artikelHvad produceres, når et radioaktivt element nedbrydes?
Næste artikelHvad er en reaktionskraft og formel?
 Varme artikler
Varme artikler
-
 Hurtige tests til tidlig diagnose af hjerteanfald og identifikation af sepsisHøjpræcisionsautomatisk dispenser til præcis påføring af specifikke reagenser. Kredit:©NUST MISIS NUST MISIS-forskere har udviklet en ny type membranteststrimmel til en kvantitativ immunokromatogr
Hurtige tests til tidlig diagnose af hjerteanfald og identifikation af sepsisHøjpræcisionsautomatisk dispenser til præcis påføring af specifikke reagenser. Kredit:©NUST MISIS NUST MISIS-forskere har udviklet en ny type membranteststrimmel til en kvantitativ immunokromatogr -
 Nyt stål for at fordoble levetiden for oliefeltsrørledningerAlexander Komissarov, en af udviklerne og en NUST MISIS forskningsmedarbejder. Kredit:© Sergey Gnuskov/NUST MISIS Det særlige ved olieudviklingsteknologi i russiske oliefelter har skabt efterspø
Nyt stål for at fordoble levetiden for oliefeltsrørledningerAlexander Komissarov, en af udviklerne og en NUST MISIS forskningsmedarbejder. Kredit:© Sergey Gnuskov/NUST MISIS Det særlige ved olieudviklingsteknologi i russiske oliefelter har skabt efterspø -
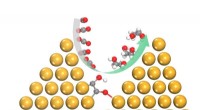 Super-selektive katalysatorer er nøglen til kulstofomdannelseDen unikke rumlige indeslutning induceret af kobbernanopyramider er afgørende for selektivt at generere ethylenglycol gennem en ny reaktionsvej. Kredit:Shizhang Qiao, Universitetet i Adelaide Kata
Super-selektive katalysatorer er nøglen til kulstofomdannelseDen unikke rumlige indeslutning induceret af kobbernanopyramider er afgørende for selektivt at generere ethylenglycol gennem en ny reaktionsvej. Kredit:Shizhang Qiao, Universitetet i Adelaide Kata -
 Forskere observerer ultrahurtig fødsel af radikalerRøntgenstråler fanger den ultrahurtige protonoverførselsreaktion i ioniseret flydende vand, danner hydroxylgruppen (OH) og hydronium-ionen (H3O+). Kredit:Argonne National Laboratory Et internation
Forskere observerer ultrahurtig fødsel af radikalerRøntgenstråler fanger den ultrahurtige protonoverførselsreaktion i ioniseret flydende vand, danner hydroxylgruppen (OH) og hydronium-ionen (H3O+). Kredit:Argonne National Laboratory Et internation
- Hvem fandt på ideen om Pangaea?
- Oversvømmelsesflytningsprogrammer mere forstyrrende for dem, der ikke bor i hvide eller velhavende …
- Hvilket er det system, der består af sol og genstande, drejer sig om det?
- Stigegående græshopper viser, at store hjerner ikke altid er bedst
- Hvad er speciel celle?
- Billede:Snowy Europe


