Hvad er forskellige i fast væske og gasser?
Forskelle mellem faste stoffer, væsker og gasser:
De vigtigste forskelle mellem faste stoffer, væsker og gasser ligger i deres struktur, partikelbevægelse og kompressibilitet . Her er en sammenbrud:
faste stoffer:
* struktur: Partikler er tæt pakket i en fast, regelmæssig ordning .
* Bevægelse: Partikler vibrerer på plads med meget begrænset bevægelse .
* Kompressibilitet: Næsten ukomprimerbar , hvilket betyder, at deres volumen ikke ændrer sig markant under pres.
* form: fast form, vedligeholdelse af deres egen form.
* bind: fast bind.
væsker:
* struktur: Partikler er tæt sammen, men ikke i et fast arrangement .
* Bevægelse: Partikler kan bevæge sig rundt men er stadig relativt tæt.
* Kompressibilitet: lidt komprimerbar , men ikke så meget som gasser.
* form: Ingen fast form tager formen på deres beholder.
* bind: fast bind.
Gasser:
* struktur: Partikler er spredt langt fra hinanden uden fast arrangement.
* Bevægelse: Partikler bevæger sig frit og tilfældigt , med høje hastigheder.
* Kompressibilitet: meget komprimerbar , deres volumen ændres markant under pres.
* form: Ingen fast form tager formen på deres beholder.
* bind: Variabel , udvides til at udfylde det tilgængelige rum.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Funktion | Solid | Væske | Gas |
| ----------------- | ---------------- | --------------- | ------------------- |
| Struktur | Rettet, regelmæssig | Luk, tilfældig | Spredning, tilfældig |
| Bevægelse | Vibrerer | Flyt rundt | Fri bevægelighed |
| Kompressibilitet | Ukomprimerbar | Lidt | Meget |
| Form | Fast | Ingen fast | Ingen fast |
| Bind | Fast | Fast | Variabel |
Eksempler:
* fast: Is, klippe, træ
* væske: Vand, olie, kviksølv
* gas: Luft, ilt, kuldioxid
At forstå disse forskelle hjælper os med at forklare materialerne ved stof og hvordan det opfører sig i forskellige tilstande.
Sidste artikelKan varmeoverførsel ved ledning ske mellem en gas og fast stof?
Næste artikelEr god varmeleder et metal?
 Varme artikler
Varme artikler
-
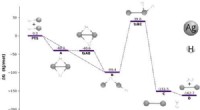 Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ
Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ -
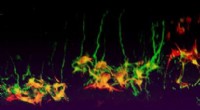 Første mikroarrayed 3-D neuronal kultur platform udvikletNeuronal respons på Sema3A-gradienter med aftagende stejlhed. Kredit:City University of Hong Kong Neuronal udvikling er ofte reguleret af den graderede fordeling af vejledende molekyler, som enten
Første mikroarrayed 3-D neuronal kultur platform udvikletNeuronal respons på Sema3A-gradienter med aftagende stejlhed. Kredit:City University of Hong Kong Neuronal udvikling er ofte reguleret af den graderede fordeling af vejledende molekyler, som enten -
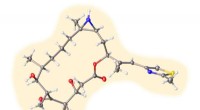 Lab skaber hårde, men øm, kræftkæmpereStruktur af en af analogerne til epothilon B, en ny forbindelse oprettet i Rice University lab af syntetisk organisk kemiker K.C. Nicolaou, der viser løfte som kræftkæmper. Kredit:Nicolaou Group/Ric
Lab skaber hårde, men øm, kræftkæmpereStruktur af en af analogerne til epothilon B, en ny forbindelse oprettet i Rice University lab af syntetisk organisk kemiker K.C. Nicolaou, der viser løfte som kræftkæmper. Kredit:Nicolaou Group/Ric -
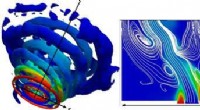 Minimering af ammoniak -brændstofemissionerTil venstre:Vortex strukturer af hvirvlende strømme. Til højre:Blanding af mønster af to ammoniakstrømme med luftstrømmen nær hvirvlerne, placeret i bunden af figuren. Farver angiver fordeling af am
Minimering af ammoniak -brændstofemissionerTil venstre:Vortex strukturer af hvirvlende strømme. Til højre:Blanding af mønster af to ammoniakstrømme med luftstrømmen nær hvirvlerne, placeret i bunden af figuren. Farver angiver fordeling af am
- Forskere udvikler værktøj til at spore havaffald, der forurener havet
- Annoncer giver muligvis ikke fordele, som virksomheder siger, de gør
- Hvad er smeltepunkt for bakelit?
- Går vi ind i den sjette store udryddelse på jorden?
- Teorien om pladetektonikforbindelser Hvilke to teorier?
- Sjælden sangfugl har måske aldrig eksisteret


