Forskere skaber pakker i nanostørrelse med genetisk kode rettet mod hjernekræftfrøceller
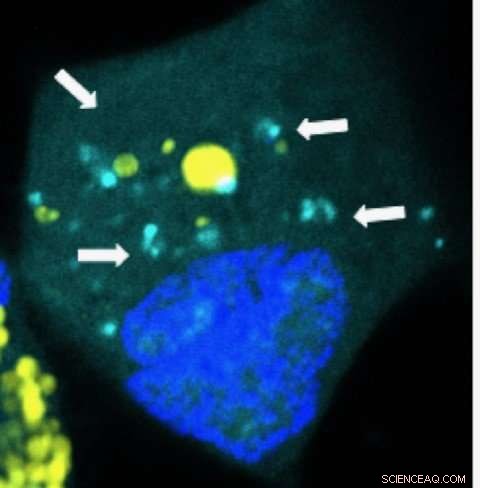
Nanopartikler, der frigiver mikroRNA'er (lyseblå) inde i en menneskelig hjernekræftcelle. Kredit:Yuan Rui, Johns Hopkins
I en "proof of concept" undersøgelse, forskere ved Johns Hopkins Medicine siger, at de med succes har leveret pakker i nanostørrelse med genetisk kode kaldet mikroRNA'er til behandling af menneskelige hjernetumorer implanteret i mus. Indholdet af de supersmå beholdere var designet til at målrette mod kræftstamceller, en slags cellulært "frø", der producerer utallige afkom og er en ubarmhjertig barriere for at befri hjernen for maligne celler.
Resultaterne af deres eksperimenter blev offentliggjort online 21. juni i Nano bogstaver .
"Hjernekræft er en af de mest kendte kræftformer med hensyn til dens genetiske sammensætning, men vi har endnu ikke udviklet en god behandling for det, " siger John Laterra, M.D., Ph.D., professor i neurologi, onkologi og neurovidenskab ved Johns Hopkins University School of Medicine og en forsker ved Kennedy Krieger Institute. "Cancerstamcellernes modstandskraft og blod-hjerne-barrieren er store forhindringer."
Blod, der kommer ind i hjernen, filtreres gennem en række kar, der fungerer som en beskyttende barriere. Men denne blod-hjerne-barriere blokerer molekylær medicin, der har potentialet til at revolutionere hjernekræftbehandling ved at målrette mod kræftstamceller, siger Laterra.
"For at modernisere hjernetumorbehandlinger, vi har brug for værktøjer og metoder, der omgår blod-hjerne-barrieren, " siger Jordan Green, Ph.D., professor i biomedicinsk teknik, oftalmologi, onkologi, neurokirurgi, materialevidenskab og teknik og kemisk og biomolekylær teknik ved Johns Hopkins University School of Medicine. "Vi har brug for teknologi til sikkert og effektivt at levere følsom genetisk medicin direkte til tumorer uden at beskadige normalt væv."
Et eksempel, Green siger, er glioblastom, den form for hjernekræft, som Arizona senator John McCain kæmper mod, som ofte kræver gentagne operationer. Læger fjerner hjernetumorvævet, som de kan se, men maligniteten vender ofte hurtigt tilbage, siger Laterra. De fleste patienter med glioblastom lever mindre end to år efter diagnosen.
Forskere har længe haft mistanke om, at kræftstamceller er roden til det, der driver tilbagevenden og spredningen af glioblastom og andre kræftformer. Disse stamceller giver anledning til andre kræftceller og, hvis de unddrager sig kirurgens kniv, kan føre til en helt ny tumor.
Laterra og Grøn, som er medlemmer af Johns Hopkins Kimmel Cancer Center, designet en måde til effektivt at levere supersmå pakker af mikroRNA'er til etablerede hjernetumorer. MikroRNA'erne retter sig mod hjernekræftstamceller for at standse deres evne til at udbrede og opretholde tumorvækst.
Pakkerne er lavet af bionedbrydeligt plast, der ligner materiale, der bruges til kirurgiske suturer, og som nedbrydes over tid. De er 1, 000 gange mindre end bredden af et menneskehår og typisk for størrelsen og formen af naturlige komponenter, som celler bruger til at kommunikere. Når kræftceller opsluger pakkerne, de går i stykker og frigiver deres mikroRNA "nyttelast" specifikt, hvor mikroRNA'erne skal handle i kræftcellerne.
Indkapslet i nanopakken er mikroRNA'er, der specifikt binder til messenger-RNA'er forbundet med to gener:HMGA1 og DNMT, som fungerer sammen for at regulere genekspressionsprogrammer i celler.
Når mikroRNA'er binder til disse messenger-RNA'er, de blokerer deres evne til at lave proteiner og deaktiverer programmer, der driver kræftcellernes stilklignende egenskaber. Uden deres stamlignende egenskaber, kræftcellerne er mere differentierede, de mister deres evne til at formere tumorer, og de kan være mere modtagelige for stråling og medicin.
Til deres eksperimenter, Johns Hopkins-forskerne implanterede humane glioblastomceller i 18 mus. For at efterligne den kliniske udfordring ved behandling af en eksisterende tumor, forskerne ventede 45 dage, før de behandlede dyrene for at være sikre på, at de havde velformede tumorer. Halvdelen af dyrene modtog infusioner af nanopakkerne indeholdende aktive mikroRNA'er direkte i deres hjernetumorer, og den anden halvdel modtog nanopakker indeholdende inaktive mikroRNA'er. For at isolere virkningen af nanopartiklerne, forskerne brugte mus, der blev opdrættet uden immunsystemets T-celler, der målretter mod kræftceller.
Fem af de ni mus, der modtog inaktive mikroRNA'er (kontroller), døde inden for to måneder, og resten af kontrolmusene døde inden for 90 dage. Tre af de ni mus, der modtog aktive mikroRNA'er, varede op til 80 dage, and six lived to 133 days. Those six were humanely euthanized, and isolated mouse brains were examined for the presence of tumors.
All of the control mice had large tumors in their brains when they died. Four of the mice that received active microRNAs and lived to 133 days had no tumors, and two had small ones.
Green says that many genetic medicines are designed to target one gene. The type of nanoparticles the Johns Hopkins team used in this study can encapsulate multiple types of microRNAs to target multiple gene networks.
When the brain cancer stem cells internalize the nanoparticle and transition to a non-stem-cell state, Laterra says, clinicians could exploit that condition, and give radiation or other drugs to kill the now-vulnerable cells.
Green says scientific teams elsewhere are developing microRNA packets using lipid-based materials, and some standard chemotherapy is delivered in a fatty nanoparticle called a liposome.
Green and Laterra say the nanoparticles in their study are able to permeate the entire tumor because rodent brains are small. mennesker, with bigger brains, may need a pump and catheter to funnel nanoparticles throughout the brain.
The Johns Hopkins team is working to scale up development of its nanoparticles and standardize their stability and quality before applying for permission to begin clinical trials on people.
 Varme artikler
Varme artikler
-
 Forskere udvider galvaniske erstatningsreaktioner til metaloxid -nanokrystallerBilledet viser γ-Fe2 O3 nanocages. Kredit:Taeghwan Hyeon] (Phys.org) - Et stort team af forskere, hvoraf de fleste er baseret i Korea, er det lykkedes at udvide processen med galvaniske udskiftnin
Forskere udvider galvaniske erstatningsreaktioner til metaloxid -nanokrystallerBilledet viser γ-Fe2 O3 nanocages. Kredit:Taeghwan Hyeon] (Phys.org) - Et stort team af forskere, hvoraf de fleste er baseret i Korea, er det lykkedes at udvide processen med galvaniske udskiftnin -
 Strukturel indsigt i det indre virke i en viral nanomaskinSkematikken repræsenterer et EM Affinity Grid (grå firkant) overtrukket med adaptermolekyler (rød og mørkeblå), der forankrer aktive rotavirus -DLPer (gul) til Affi nity Grid. Cryo-elektronmikroskopi
Strukturel indsigt i det indre virke i en viral nanomaskinSkematikken repræsenterer et EM Affinity Grid (grå firkant) overtrukket med adaptermolekyler (rød og mørkeblå), der forankrer aktive rotavirus -DLPer (gul) til Affi nity Grid. Cryo-elektronmikroskopi -
 Nanobodies kan indeholde spor til nye COVID-19-terapierVisualisering af SARS-CoV-2-virus med nanobodies (lilla), der knytter sig til virus-spike-proteinet. Kredit:Dr. Drew Berry i samarbejde med lektor Wai-Hong Tham WEHI-forskere studerer nanobodies -
Nanobodies kan indeholde spor til nye COVID-19-terapierVisualisering af SARS-CoV-2-virus med nanobodies (lilla), der knytter sig til virus-spike-proteinet. Kredit:Dr. Drew Berry i samarbejde med lektor Wai-Hong Tham WEHI-forskere studerer nanobodies - -
 Forsker i grafen nanoelektronik til en post-silicium verdenEn ny undersøgelse fra forskere ved Rensselaer Polytechnic Institute beskriver, hvordan stabling af nanobånd af grafen kan øge materialets evne til at overføre elektriske ladninger. Opdagelsen underst
Forsker i grafen nanoelektronik til en post-silicium verdenEn ny undersøgelse fra forskere ved Rensselaer Polytechnic Institute beskriver, hvordan stabling af nanobånd af grafen kan øge materialets evne til at overføre elektriske ladninger. Opdagelsen underst
- Burkina Faso -undersøgelse viser sammenhæng mellem jordforringelse og migration
- Kunne Twitter være et værktøj til at forbedre skoler?
- United Airlines beordrer 50 Airbus -fly til at erstatte Boeing 757'er
- Sådan fungerer posttraumatisk stresslidelse
- Sådan fremstilles en model af en menneskelig kugleuttag Joint
- WWII-forsker:Søvraget skal være et fly af en amerikansk MIA-pilot


