Ingeniører udvikler nanopartikler, der krydser blod-hjerne-barrieren
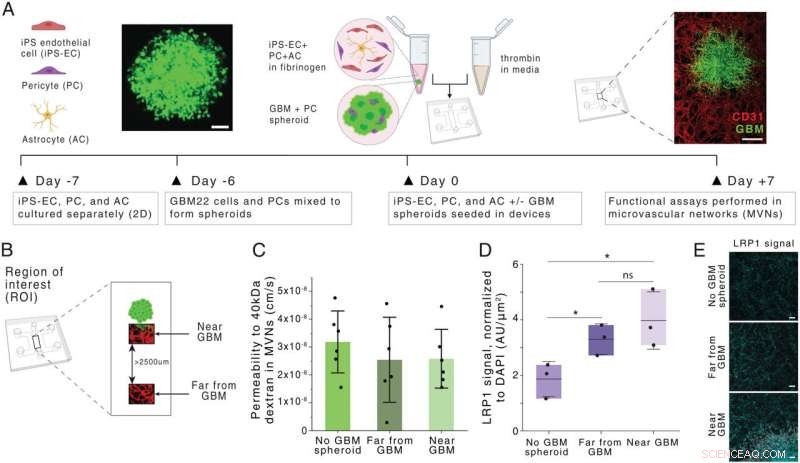
Generering og karakterisering af en glioblastom BBB MVN-model (BBB-GBM-model). (A) Skematisk dannelse af BBB-GBM i en mikrofluidisk enhed. (Skalasøjler:100 µm [Venstre] og 500 µm [Højre].) (B) ROI'er identificeret rumligt inden for BBB-GBM-modellen, med langt fra GBM ROI'er identificeret til at være mindst 2.500 µm væk fra GBM-sfæroiden. (C) Permeabilitet for 40-kDa dextran i de vaskulære netværk på tværs af forskellige ROI-lokationer; hvert punkt repræsenterer n =1 enhed. (D) Ekspression af LRP1 på tværs af forskellige ROI-lokationer, som vurderet via immunfluorescensfarvning; hvert punkt repræsenterer n =1 enhed. (E) Repræsentative mikrofotografier af LRP1-farvning kvantificeret i D. (Skala søjler:100 µm.) I alle grafer repræsenterer søjler middelværdi ± SD. ns, ikke signifikant. *P <0,05. Statistiske analyser er beskrevet i Materialer og metoder. AU, vilkårlige enheder; 2D, todimensional. Kredit:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2118697119
Der er i øjeblikket få gode behandlingsmuligheder for glioblastom, en aggressiv type hjernekræft med høj dødelighed. En grund til, at sygdommen er så svær at behandle, er, at de fleste kemoterapimidler ikke kan trænge ind i blodkarrene, der omgiver hjernen.
Et hold af MIT-forskere udvikler nu lægemiddelbærende nanopartikler, der ser ud til at komme ind i hjernen mere effektivt end lægemidler givet alene. Ved hjælp af en menneskelig vævsmodel, de designede, som nøjagtigt replikerer blod-hjerne-barrieren, viste forskerne, at partiklerne kunne trænge ind i tumorer og dræbe glioblastomceller.
Mange potentielle glioblastombehandlinger har vist succes i dyremodeller, men endte så med at fejle i kliniske forsøg. Dette tyder på, at der er behov for en bedre form for modellering, siger Joelle Straehla, Charles W. og Jennifer C. Johnson Clinical Investigator ved MIT's Koch Institute for Integrative Cancer Research, en instruktør ved Harvard Medical School og en pædiatrisk onkolog ved Dana-Farber Cancer Institute.
"Vi håber, at vi ved at teste disse nanopartikler i en meget mere realistisk model kan skære meget af den tid og energi, der er spildt på at prøve ting i klinikken, der ikke virker," siger hun. "For denne type hjernetumor har der desværre været hundredvis af forsøg, der har haft negative resultater."
Straehla og Cynthia Hajal, en postdoc ved Dana-Farber, er hovedforfatterne af undersøgelsen, som vises i denne uge i Proceedings of the National Academy of Sciences . Paula Hammond, professor ved MIT-instituttet, leder af afdelingen for kemiteknik og medlem af Koch-instituttet; og Roger Kamm, Cecil og Ida Greens fremtrædende professor i biologisk og maskinteknik, er ledende forfattere af papiret.
Modellering af blod-hjerne-barrieren
For adskillige år siden begyndte Kamms laboratorium at arbejde på en mikrofluidisk model af hjernen og de blodkar, der udgør blod-hjerne-barrieren.
Fordi hjernen er et så vigtigt organ, er blodkarrene omkring hjernen meget mere restriktive end andre blodkar i kroppen for at holde potentielt skadelige molekyler ude.
For at efterligne denne struktur i en vævsmodel dyrkede forskerne patientafledte glioblastomceller i en mikrofluidisk enhed. Derefter brugte de menneskelige endotelceller til at dyrke blodkar i små rør, der omgiver tumorcellernes sfære. Modellen inkluderer også pericytter og astrocytter, to celletyper, der er involveret i transport af molekyler over blod-hjerne-barrieren.
Mens Hajal arbejdede på denne model som kandidatstuderende i Kamms laboratorium, fik hun forbindelse med Straehla, dengang en postdoc i Hammonds laboratorium, som var interesseret i at finde nye måder at modellere nanopartikel-medikamentlevering til hjernen. At få medicin over blod-hjerne-barrieren er afgørende for at forbedre behandlingen af glioblastom, som normalt behandles med en kombination af kirurgi, stråling og oral kemoterapi temozolomid. Den femårige overlevelsesrate for sygdommen er mindre end 10 procent.
Hammonds laboratorium var banebrydende for en teknik kaldet lag-for-lag samling, som de kan bruge til at skabe overfladefunktionaliserede nanopartikler, der bærer lægemidler i deres kerne. De partikler, som forskerne udviklede til denne undersøgelse, er belagt med et peptid kaldet AP2, som i tidligere arbejde har vist sig at hjælpe nanopartikler med at komme gennem blod-hjernebarrieren. Uden nøjagtige modeller var det imidlertid vanskeligt at studere, hvordan peptiderne hjalp med transport over blodkar og ind i tumorceller.
Da forskerne leverede disse nanopartikler til vævsmodeller af både glioblastom og sundt hjernevæv, fandt de ud af, at partiklerne belagt med AP2-peptidet var meget bedre til at trænge ind i karrene omkring tumorerne. De viste også, at transporten skete på grund af binding af en receptor kaldet LRP1, som er mere udbredt nær tumorer end i normale hjernekar.
Forskerne fyldte derefter partiklerne med cisplatin, et almindeligt anvendt kemoterapilægemiddel. Når disse partikler blev coatet med det målrettede peptid, var de i stand til effektivt at dræbe glioblastomtumorceller i vævsmodellen. Men partikler, der ikke havde peptiderne, endte med at beskadige de raske blodkar i stedet for at målrette mod tumorerne.
"Vi så øget celledød i tumorer, der blev behandlet med den peptid-coatede nanopartikel sammenlignet med de bare nanopartikler eller frit lægemiddel. Disse coatede partikler viste mere specificitet for at dræbe tumoren, i forhold til at dræbe alt på en uspecifik måde," siger Hajal.
Mere effektive partikler
Forskerne forsøgte derefter at levere nanopartiklerne til mus ved hjælp af et specialiseret kirurgisk mikroskop til at spore nanopartiklerne, der bevæger sig gennem hjernen. De fandt ud af, at partiklernes evne til at krydse blod-hjerne-barrieren var meget lig det, de havde set i deres menneskelige vævsmodel.
De viste også, at coatede nanopartikler, der bærer cisplatin, kunne bremse tumorvækst hos mus, men effekten var ikke så stærk som det, de så i vævsmodellen. Dette kan skyldes, at tumorerne var i et mere avanceret stadium, siger forskerne. De håber nu at teste andre lægemidler, båret af en række forskellige nanopartikler, for at se, hvilke der kan have den største effekt. De planlægger også at bruge deres tilgang til at modellere andre typer hjernetumorer.
"Dette er en model, som vi kunne bruge til at designe mere effektive nanopartikler," siger Straehla. "Vi har kun testet én type hjernetumor, men vi ønsker virkelig at udvide og teste dette med en masse andre, især sjældne tumorer, som er svære at studere, fordi der måske ikke er så mange prøver tilgængelige."
Forskerne beskrev metoden, de brugte til at skabe hjernevævsmodellen i en nylig Nature Protocols papir, så andre laboratorier også kan bruge det. + Udforsk yderligere
En nanopartikel og inhibitor udløser immunsystemet og overliste hjernekræft
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Forskere undersøger nanogolds potentiale inden for biomedicinBrug af synkrotronen til at studere nanogoldpartikler Peng Zhang er begejstret for guld, og det burde du også være. I særdeleshed, han er begejstret for nanogold, strukturer af en håndfuld atomer,
Forskere undersøger nanogolds potentiale inden for biomedicinBrug af synkrotronen til at studere nanogoldpartikler Peng Zhang er begejstret for guld, og det burde du også være. I særdeleshed, han er begejstret for nanogold, strukturer af en håndfuld atomer, -
 Design af en bedre superleder med geometrisk frustrationSystemopsætningen. Kredit:Xiaoyu Ma og Yong-Lei Wang, med tilladelse fra University of Notre Dame. Superledere indeholder små tornadoer af superstrøm, kaldet vortex filamenter, der skaber modstand
Design af en bedre superleder med geometrisk frustrationSystemopsætningen. Kredit:Xiaoyu Ma og Yong-Lei Wang, med tilladelse fra University of Notre Dame. Superledere indeholder små tornadoer af superstrøm, kaldet vortex filamenter, der skaber modstand -
 Røntgenundersøgelse afslører, hvordan blysulfidpartikler selvorganiserer sig i realtidBlysulfid-nanopartiklerne, som er omkring otte nanometer (milliontedele af en millimeter) i størrelse, indledningsvis arrangere sig selv i et lag med sekskantet symmetri. Kredit:Universitetet i Hambor
Røntgenundersøgelse afslører, hvordan blysulfidpartikler selvorganiserer sig i realtidBlysulfid-nanopartiklerne, som er omkring otte nanometer (milliontedele af en millimeter) i størrelse, indledningsvis arrangere sig selv i et lag med sekskantet symmetri. Kredit:Universitetet i Hambor -
 Binder knude:Nye DNA -nanostrukturerHao Yan og hans kolleger designede og konstruerede en række knyttede former, (hver måler kun milliarder af en meter i længden), fra en enkelt streng af DNA. De selvsamlende nanostrukturer følger en pr
Binder knude:Nye DNA -nanostrukturerHao Yan og hans kolleger designede og konstruerede en række knyttede former, (hver måler kun milliarder af en meter i længden), fra en enkelt streng af DNA. De selvsamlende nanostrukturer følger en pr


