Nyligt opdagede krypterede peptider fundet i humant plasma udviser antibiotiske egenskaber
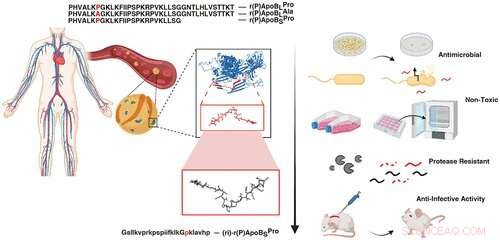
Grafisk abstrakt. Kredit:DOI:10.1021/acsnano.1c04496
Stigningen af lægemiddelresistente bakterieinfektioner er et af verdens mest alvorlige globale sundhedsproblemer, der anslås at forårsage 10 millioner dødsfald årligt i år 2050. Nogle af de mest virulente og antibiotika-resistente bakterielle patogener er den førende årsag til livstruende , hospitalserhvervede infektioner, særligt farlige for immunkompromitterede og kritisk syge patienter. Traditionel og kontinuerlig syntese af antibiotika vil simpelthen ikke være i stand til at følge med bakterieudviklingen.
For at undgå den kontinuerlige proces med at syntetisere nye antibiotika for at målrette bakterier, efterhånden som de udvikler sig, har Penn Engineers kigget på en ny, naturlig ressource for antibiotikamolekyler.
En nylig undersøgelse af søgningen efter krypterede peptider med antimikrobielle egenskaber i det menneskelige proteom har lokaliseret naturligt forekommende antibiotika i vores egen krop. Ved at bruge en algoritme til at lokalisere specifikke sekvenser i vores proteinkode, har et team af Penn-forskere sammen med samarbejdspartnere, ledet af César de la Fuente, præsidentassistentprofessor i psykiatri, bioteknik, mikrobiologi og kemisk og biomolekylær ingeniørvidenskab, og Marcelo Torres, en post doc i de la Fuentes laboratorium, var i stand til at lokalisere nye peptider eller aminosyrekæder, der, når de blev spaltet, indikerede deres potentiale til at afværge skadelige bakterier.
Nu i en ny undersøgelse offentliggjort i ACS Nano , teamet sammen med Angela Cesaro, hovedforfatteren og post doc i de la Fuentes laboratorium, har identificeret tre forskellige antimikrobielle peptider afledt af et protein i humant plasma og demonstrerer deres evner i musemodeller. Angela Cesaro udførte en stor del af aktiviteterne under sin ph.d. under tilsyn af den tilsvarende forfatter, professor Angela Arciello, fra University of Napoli Federico II. Samarbejdsundersøgelsen omfatter også Utrecht University i Holland.
"Vi identificerede det kardiovaskulære system som et hot spot for potentielle antimikrobielle stoffer ved hjælp af en algoritmisk tilgang," siger de la Fuente. "Så kiggede vi nærmere på et specifikt protein i plasmaet."
Apolipoprotein B er et protein i blodplasma, der transporterer lipider, såsom kolesterol, gennem hele kroppen. Men når dette protein nedbrydes, udviser dets peptidbyggesten helt forskellige funktioner.
Ved hjælp af deres algoritme isolerede holdet tre peptider fra Apolipoprotein B og testede deres evne til at afværge forskellige typer bakterier, inklusive dem, der forårsager staph-infektioner og lungebetændelse.
Hvert af de tre peptider var i stand til at trænge igennem den cytoplasmatiske membran af bakterierne, dræbe cellen og hæmme væksten af biofilm. Derudover, når de blev brugt sammen med hinanden eller med farmaceutiske antibiotika, øgedes deres antibiotiske virkning betydeligt, hvilket krævede en mindre dosis for at bekæmpe infektion.
Holdet vurderede også, om disse peptider fremmer antibiotikaresistens i disse bakterier.
"Der er mange måder, hvorpå vores immunceller og antimikrobielle peptider angriber og bekæmper bakteriel infektion," siger de la Fuente. "Det unikke i de peptider, vi undersøger, er deres evne til at angribe bakteriemembranen, en struktur, der kræver flere gener at opbygge og vedligeholde. Typiske antibiotika er kun rettet mod ét gen eller aspekt af bakterieceller, hvilket gør det relativt nemt for bakterier at udvikle resistens. , så antimikrobielle stoffer, såsom de peptider, vi beskriver her, der angriber flere mål på én gang, er mere succesrige til at hæmme bakteriel resistens."
"I resistensudviklingseksperimentet, vi udførte i vores laboratorium, var det overraskende at se, hvor hurtigt nye bakterier, der er resistente over for almindelige antibiotika, udvælges, og tværtimod, hvordan de krypterede peptider opdaget i plasmaet ikke fører til denne type selektion. ," siger Cesaro. "Denne adfærd kan stamme fra en værtsforsvarsmekanisme udviklet i mennesker og evolutionært bevaret over tid. Dette arbejde åbner nye veje for antimikrobiel opdagelse i proteiner, der ikke er relateret til immunsystemet, og dette er meget spændende, da der på nuværende tidspunkt er hårdt brug for nye antibiotika ."
Faktisk er det de fysisk-kemiske egenskaber ved selve bakteriemembranen, der gør det muligt for peptiderne at være så succesfulde i denne kamp.
"Peptider virker hurtigt på membranerne af invaderende bakterier gennem forskellige mekanismer," siger Torres. "I dette tilfælde fungerer bakteriemembranerne som magneter, der tiltrækker de antimikrobielle peptider, og fordi disse membranegenskaber er komplekse og ikke let kan ændres for at undgå peptidtiltrækning, bliver bakterierne følgelig overvundet af antimikrobielle peptider og ødelagt, med flere forhindringer i måde at udvikle enhver modstand i den næste generation."
Fjernelse af resistenspotentialet betyder, at disse peptider kan bruges som antibiotika til en bred vifte af bakterielle infektioner og forblive effektive længere end traditionelle antibiotika.
Endelig, for at øge stabiliteten til test af den antimikrobielle funktion in vivo, blev et peptid designet, syntetiseret og brugt i en musemodel. Forsøget viste en hudbakteriel infektion behandlet med det syntetiske peptid baseret på de naturlige antibiotika identificeret fra Apolipoprotein B, som var i stand til at udrydde infektionen på fire dage med en enkelt dosis.
"Blodet var et klart sted at lede efter krypterede peptider som bestemt af algoritmen, og disse resultater giver en forbindelse mellem humane plasmaproteiner og vores medfødte immunitet," siger de la Fuente. "Vi fortsætter med at lede efter disse peptider ud over blodet, på alle andre steder i kroppen for også at give den forbindelse til nerve-, fordøjelses- og immunsystemet." + Udforsk yderligere
Forskere viser, at 'krypterede' peptider kan være en udspringer af naturlige antibiotika
 Varme artikler
Varme artikler
-
 Kemikere laver nye siliciumbaserede nanomaterialerVed at justere fremstillingsteknikken, forskere kan lave forskellige halvlederstrukturer, herunder nanoplader, der ligger fladt eller står oprejst. Kredit:Koski lab / Brown University Kemikere fra
Kemikere laver nye siliciumbaserede nanomaterialerVed at justere fremstillingsteknikken, forskere kan lave forskellige halvlederstrukturer, herunder nanoplader, der ligger fladt eller står oprejst. Kredit:Koski lab / Brown University Kemikere fra -
 Varme nanopartikler til kræftbehandlingerSkema af guld- og jernoxidaggregater med silica skal. Til venstre:elektronmikroskopisk billede af et aggregat. Kredit:Georgios Sotiriou / ETH Zürich Nanopartikler har et stort potentiale inden for
Varme nanopartikler til kræftbehandlingerSkema af guld- og jernoxidaggregater med silica skal. Til venstre:elektronmikroskopisk billede af et aggregat. Kredit:Georgios Sotiriou / ETH Zürich Nanopartikler har et stort potentiale inden for -
 Svovl i hver pore:Forbedrede batterier med carbon nanopartiklerFra smartphones til e-cykler, antallet af mobile elektroniske enheder vokser støt rundt om i verden. Som resultat, der er et øget behov for små og lette batterier, alligevel kraftfuld. Da potentialet
Svovl i hver pore:Forbedrede batterier med carbon nanopartiklerFra smartphones til e-cykler, antallet af mobile elektroniske enheder vokser støt rundt om i verden. Som resultat, der er et øget behov for små og lette batterier, alligevel kraftfuld. Da potentialet -
 Vat viser sig at være effektiv til at adskille enkeltvæggede kulstofnanorørKredit:Kazan Federal University Carbon nanorør (CNT) er en familie af 1D nanostrukturer med adskillige verificerede applikationer, muliggjort på grund af deres fremragende mekaniske, optiske og le
Vat viser sig at være effektiv til at adskille enkeltvæggede kulstofnanorørKredit:Kazan Federal University Carbon nanorør (CNT) er en familie af 1D nanostrukturer med adskillige verificerede applikationer, muliggjort på grund af deres fremragende mekaniske, optiske og le
- Fundede NASA en mystisk døråbning på Mars? Nej, men det er ingen grund til at stoppe med at lede
- Japans berygtede alarmsystem løber op mod grænser
- Virkningerne af Alger i Drikkevand
- Langsomme klimaændringer kan vende udtørring i subtroperne
- Otte nye varme Jupitere opdaget af astronomer
- Jordens nedre kappe kan oxideres i nærvær af vand


