Computer i nanoskala styrer proteinets funktion, påvirker celleadfærd
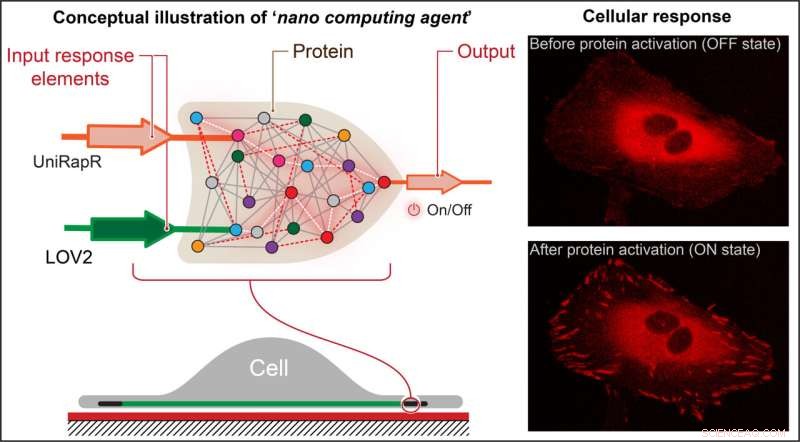
Forskere skabte en transistorlignende 'logisk gate', som er en form for beregningsoperation, hvor flere input styrer et output og indlejrede det i et protein. De fandt ud af, at de ikke kun hurtigt kunne aktivere proteinet ved hjælp af lys og stoffet rapamycin, men også at denne aktivering resulterede i, at cellerne undergik interne ændringer, der forbedrede deres klæbeevne, hvilket i sidste ende mindskede deres motilitet. Kredit:Penn State
Skabelsen af computere i nanoskala til brug i præcisionssundhedspleje har længe været en drøm for mange forskere og sundhedsudbydere. Nu har forskere ved Penn State for første gang produceret et nanocomputermiddel, der kan kontrollere funktionen af et bestemt protein, der er involveret i cellebevægelser og kræftmetastaser. Forskningen baner vejen for konstruktion af komplekse nanoskala-computere til forebyggelse og behandling af kræft og andre sygdomme.
Nikolay Dokholyan, G. Thomas Passananti-professor, Penn State College of Medicine, og hans kolleger – inklusive Yashavantha Vishweshwaraiah, postdoc i farmakologi, Penn State – skabte en transistorlignende 'logisk port', som er en form for beregningsoperation, hvor flere indgange styrer en udgang.
"Vores logiske port er kun begyndelsen på, hvad man kan kalde cellulær computing," sagde han, "men det er en vigtig milepæl, fordi den demonstrerer evnen til at indlejre betingede operationer i et protein og kontrollere dets funktion," sagde Dokholyan. "Det vil giver os mulighed for at få en dybere forståelse af menneskets biologi og sygdom og introducerer muligheder for udvikling af præcisionsterapi."
Holdets logiske gate bestod af to sensordomæner designet til at reagere på to input - lys og stoffet rapamycin. Holdet målrettede protein focal adhesion kinase (FAK), fordi det er involveret i celleadhæsion og bevægelse, som er de første trin i udviklingen af metastatisk cancer.
"Først introducerede vi et rapamycinfølsomt domæne, kaldet uniRapr, som laboratoriet tidligere havde designet og undersøgt, i genet, der koder for FAK," sagde Vishweshwaraiah. "Dernæst introducerede vi domænet, LOV2, som er følsomt over for lys. Da vi optimerede begge domæner, kombinerede vi dem til et endeligt logic-gate design."
Holdet indsatte det modificerede gen i HeLa-kræftceller og observerede ved hjælp af konfokal mikroskopi cellerne in vitro. De undersøgte virkningerne af hver af inputs separat, såvel som den kombinerede effekt af inputs, på cellernes adfærd.
De opdagede, at de ikke kun hurtigt kunne aktivere FAK ved hjælp af lys og rapamycin, men også at denne aktivering resulterede i, at cellerne undergik interne ændringer, der forbedrede deres klæbeevne, hvilket i sidste ende mindskede deres motilitet.
Deres resultater offentliggjort i dag (16. november) i tidsskriftet Nature Communications .
"Vi viser for første gang, at vi kan bygge et fungerende nanocomputermiddel i levende celler, der kan kontrollere celleadfærd," sagde Vishweshwaraiah. "Vi har også opdaget nogle interessante træk ved FAK-proteinet, såsom de ændringer, det udløser i celler, når det aktiveres."
Dokholyan bemærkede, at holdet håber på til sidst at teste disse nanocomputermidler in vivo i levende organismer.
Andre Penn State forfattere på papiret omfatter Jiaxing Chen, kandidatstuderende; Venkat R. Chirasani, postdoc; og Erdem D. Tabdanov, adjunkt i farmakologi. + Udforsk yderligere
Forvandling af celler til computere med proteinlogiske porte
Sidste artikelTættere på en enkel og effektiv metode til kvantekryptering
Næste artikelBorophenes gjort let
 Varme artikler
Varme artikler
-
 Mere effektiv risikovurdering for nanomaterialerKredit:CC0 Public Domain Nanoteknologi blomstrer, men risikovurdering for disse bittesmå partikler er en besværlig proces, der giver betydelige udfordringer for det tyske forbundsinstitut for risi
Mere effektiv risikovurdering for nanomaterialerKredit:CC0 Public Domain Nanoteknologi blomstrer, men risikovurdering for disse bittesmå partikler er en besværlig proces, der giver betydelige udfordringer for det tyske forbundsinstitut for risi -
 Et metal, der opfører sig som vandI et nyt blad udgivet i Videnskab , forskere ved Harvard og Raytheon BBN Technology har fremmet vores forståelse af grafens grundlæggende egenskaber, for første gang observerer elektroner i et metal
Et metal, der opfører sig som vandI et nyt blad udgivet i Videnskab , forskere ved Harvard og Raytheon BBN Technology har fremmet vores forståelse af grafens grundlæggende egenskaber, for første gang observerer elektroner i et metal -
 En nem, skalerbar og direkte metode til syntetisering af grafen i siliciummikroelektronikDette er en wafer-skala (4 tommer i diameter) syntese af flerlagsgrafen ved hjælp af højtemperatur carbonionimplantation på nikkel/SiO2/silicium. Kredit:J.Kim/Korea University, Korea I det sidste
En nem, skalerbar og direkte metode til syntetisering af grafen i siliciummikroelektronikDette er en wafer-skala (4 tommer i diameter) syntese af flerlagsgrafen ved hjælp af højtemperatur carbonionimplantation på nikkel/SiO2/silicium. Kredit:J.Kim/Korea University, Korea I det sidste -
 En fantastisk simpel opskrift på korund i nanometerstørrelseTredimensionel visualisering af korund nanopartikler. Et rigtigt mikroskopisk billede i baggrunden (falske farver). Kredit:IFJ PAN, MPI Kofo Næsten alle bruger aluminiumoxid i nanometer i disse da
En fantastisk simpel opskrift på korund i nanometerstørrelseTredimensionel visualisering af korund nanopartikler. Et rigtigt mikroskopisk billede i baggrunden (falske farver). Kredit:IFJ PAN, MPI Kofo Næsten alle bruger aluminiumoxid i nanometer i disse da
- Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitter
- Administrerende direktører med ualmindelige navne har en tendens til at implementere ukonventionell…
- Matematiker foreslår et skema til løsning af telegrafligninger
- Ufølsomt hvidt publikum får sorte til at føle sig uvelkomne ved kulturelle begivenheder
- Rumvandrende astronauter forbereder station til nye solvinger
- Twitter-advokat siger, at botdata givet til Musk eksplicit var et skøn


