Forskerhold undersøger de larvelignende bakterier, der kravler i vores mund
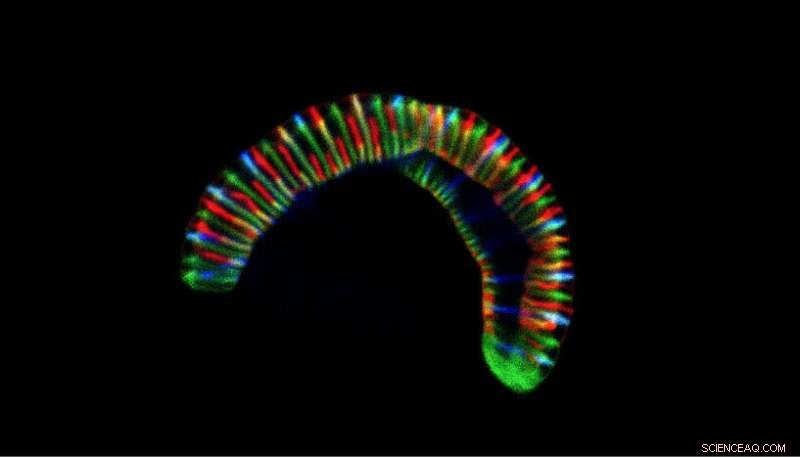
Konfokalt mikroskopbillede af den larvelignende bakterie Conchiformibius steedae, op til 7 µm lang, inkuberet med fluorescerende mærkede cellevægsforstadier for at følge dens cellevækst. Kredit:CC BY 4.0 / Philipp Weber og Silvia Bulgheresi
Sandsynligvis overlever bakterier i mundhulen, og bakterier har udviklet sig til at dele sig langs deres længdeakse uden at skilles fra hinanden. Et forskerhold ledet af miljøcellebiolog Silvia Bulgheresi fra universitetet i Wien og mikrobiel genetiker Frédéric Veyrier fra Institut national de la recherche scientifique (INRS) har netop offentliggjort deres nye indsigter i Nature Communications . I deres arbejde beskrev de disse larvelignende bakteriers delingstilstand og deres udvikling fra en stavformet forfader. De foreslår at etablere Neisseriaceae orale bakterier som nye modelorganismer, der kan hjælpe med at udpege nye antimikrobielle mål.
Selvom vores mund huser over 700 arter af bakterier, og dens mikrobiota er lige så forskellig som i vores tarm, er der ikke meget kendt om, hvordan orale bakterier vokser og deler sig. Munden er et hårdt sted at leve i for bakterier. Epitelcellerne, der beklæder den indre overflade af mundhulen, udskilles konstant, og sammen med spytstrømmen vil organismer, der bebor denne overflade, derfor kæmpe for tilknytning.
Det er muligt, at bakterier af familien Neisseriaceae for bedre at holde sig til munden har udviklet en ny måde at formere sig på. Hvor typiske stænger deler sig på tværs og derefter løsnes fra hinanden, hæfter nogle kommensale Neisseriaceae, der lever i vores mund, sig imidlertid til underlaget med deres spidser og deler sig på langs - langs deres lange akse. Ud over det, når celledelingen er afsluttet, forbliver de knyttet til hinanden og danner larvelignende filamenter. Nogle celler i det resulterende filament antager også forskellige former, muligvis for at udføre specifikke funktioner til gavn for hele filamentet. Forskerne forklarer:"Multicellularitet gør samarbejde mellem celler muligt, for eksempel i form af arbejdsdeling, og kan derfor hjælpe bakterier til at overleve ernæringsstress."
Holdet af forskere brugte først elektronmikroskopi til at undersøge, på tværs af Neisseriaceae-familien, bakterielle celleformer, der omfatter de to standardcelleformer (stav og kokos) ud over de larvelignende filamenter. Ved at sammenligne deres celleformer og genomer i hele Neisseriaceae-familien kunne forskerne udlede, at de flercellede, langsgående delende bakterier udviklede sig ud af stavformede, tværgående delende bakterier. Desuden kunne de finde ud af, hvilke gener der sandsynligvis var ansvarlige for den usædvanlige multiplikationsstrategi.
De brugte derefter fluorescensmærkningsteknikker til at visualisere progressionen af cellevækst i de multicellulære bakterier og sammenlignede til sidst den genetiske sammensætning af disse med "klassiske" stavformede arter. Til sidst forsøgte de at genskabe den evolution ved at introducere de genetiske ændringer i stavformede Neisseriaceae. Selvom de ikke kunne tvinge stavformede bakterier til at blive flercellede, resulterede genetisk manipulation i længere og tyndere celler. "Vi spekulerer i, at celleformen i løbet af evolutionen, gennem en omarbejdning af forlængelses- og deleprocesserne, ændrede sig, måske for bedre at trives i mundhulen," sagde Frédéric Veyrier.
"Udover at hjælpe os med at forstå, hvordan celleformen udviklede sig, kan multicellulære Neisseriaceae være nyttige til at studere, hvordan bakterier lærte at leve knyttet til overfladen af dyr, det eneste sted, de har vist sig at forekomme indtil videre. Halvdelen af os bærer dem i vores mund, forresten," forklarer Silvia Bulgheresi fra Institut for Funktionel og Evolutionær Økologi ved Universitetet i Wien.
Philipp Weber fra University of Vienna, Ph.D., en studerende på Bulgheresis team, som også arbejdede på undersøgelsen, fremhæver dog, at "at udvide det cellebiologiske felt til yderligere morfologier og symbiotiske arter er også afgørende for at øge puljen af protein mål (f.eks. antibiotikamål) til biofarmaceutiske anvendelser."
Sammy Nyongesa, en ph.d. studerende i Veyriers team fra INRS, tilføjer:"En evolutionær tilgang, som den, der er foretaget her for Neisseriaceae, kan kaste lys over nye, uforudsete proteinmål." + Udforsk yderligere
Ukonventionel celledeling i Det Caribiske Hav
 Varme artikler
Varme artikler
-
 Mennesker udviklede sig med deres mikrobiomer. Ligesom gener går dine tarmmikrober fra en generatio…Kredit:CC0 Public Domain Da de første mennesker flyttede ud af Afrika, bar de deres tarmmikrober med sig. Det viser sig, at disse mikrober også udviklede sig sammen med dem. Det menneskelige tarmm
Mennesker udviklede sig med deres mikrobiomer. Ligesom gener går dine tarmmikrober fra en generatio…Kredit:CC0 Public Domain Da de første mennesker flyttede ud af Afrika, bar de deres tarmmikrober med sig. Det viser sig, at disse mikrober også udviklede sig sammen med dem. Det menneskelige tarmm -
 Colombia,Ikke Finland, Kan være det lykkeligste land i verden Colombianere støtter deres land under en fodboldkamp. Colombia rangerer som det lykkeligste land i verden, når folk bliver spurgt om følels
Colombia,Ikke Finland, Kan være det lykkeligste land i verden Colombianere støtter deres land under en fodboldkamp. Colombia rangerer som det lykkeligste land i verden, når folk bliver spurgt om følels -
 At blive mere ulveagtig er nøglen til fremtiden for prærieulvePå dette billede fra 2008 leveret af Josh Harrison, en coyote står på Mount Auburn Cemetery i Cambridge, Mass. Coyotes har levet i øst siden 1930erne, og nyere genetiske test har vist, at de faktisk e
At blive mere ulveagtig er nøglen til fremtiden for prærieulvePå dette billede fra 2008 leveret af Josh Harrison, en coyote står på Mount Auburn Cemetery i Cambridge, Mass. Coyotes har levet i øst siden 1930erne, og nyere genetiske test har vist, at de faktisk e -
 Sex og magt i dyreriget:Syv dyr, der får dig til at genoverveje, hvad du tror, du vedDen hvidhalsede jacobin (Florisuga mellivora) er en mellemstor kolibri Milano. Kredit:Zygmunt/Shutterstock Det er let at antage, at alle dyr har en pæn skillelinje mellem kønnene, fordi forskellene
Sex og magt i dyreriget:Syv dyr, der får dig til at genoverveje, hvad du tror, du vedDen hvidhalsede jacobin (Florisuga mellivora) er en mellemstor kolibri Milano. Kredit:Zygmunt/Shutterstock Det er let at antage, at alle dyr har en pæn skillelinje mellem kønnene, fordi forskellene
- Hvad koster en hval?
- Hvordan fungerer et kalorimeter?
- Søvnvaner hos pandemiske teenagere tyder på fordele ved senere skolestarttider
- Innovativ flad optik vil indlede den næste teknologiske revolution
- Fairtrade gavner landarbejdere i Afrika, men ikke den fattigste af de fattige
- Stjerne-lig kaster lys over oprindelsen af kosmiske stråler


