Nanoskala platform har til formål at kontrollere proteinniveauer
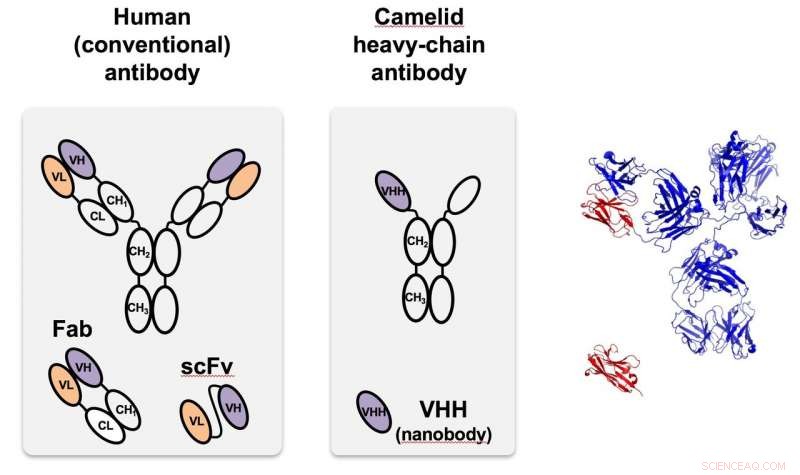
Kamelid nanobody (i midten), først identificeret i kameler, er et tungkædet antistof, der er meget mindre og lettere at programmere end antistoffer, der findes i de fleste organismer, inklusive mennesker, sådan til venstre. Til højre, det monomere camelid (rødt) sammenlignes med strukturen af det humane antistof i fuld størrelse. VHH er en nanobody designet til at målrette grønne fluorescerende proteiner, der bruges i proof-of-principle tests hos Rice. Kredit:Segatori Research Group/Rice University
Et antistof i nanoskala, der først blev fundet i kameler kombineret med et proteinnedbrydende molekyle, er en effektiv ny platform til at kontrollere proteinniveauer i celler, ifølge Rice University-forskere. Teknikken kunne hjælpe med grundlæggende forskning i cellulær dynamik samt design af syntetiske genkredsløb.
Ris kemisk og biomolekylær ingeniør Laura Segatori, tidligere kandidatstuderende Wenting Zhao og tidligere bachelorstuderende Lara Pferdehirt opfandt et bifunktionelt genkendelsessystem, de kalder NanoDeg. Det giver dem mulighed for at målrette specifikke proteiner i en celle og nøje regulere deres nedbrydning.
Plug-and-play-systemet vil give syntetiske biologer mulighed for at studere funktionen af et specifikt protein i det cellulære miljø ved at vurdere, hvordan proteinekspressionsniveauet påvirker en celles liv, sagde Segatori.
Forskningen vises i tidsskriftet American Chemical Society ACS syntetisk biologi .
NanoDeg accelererer proteolyse - den enzymatiske nedbrydning af proteiner - for at kontrollere niveauerne af målrettede proteiner efter translation.
En funktion udspringer af det enkeltkædede antistof fra kamelider, som kan tilpasses til at målrette specifikke proteiner. Da antistofferne blev opdaget i kameler (og senere hajer), forskere genkendte hurtigt deres unikke egenskaber, inklusive deres lille størrelse, høj opløselighed og evne til at genkende selv mål, der er skjulte eller i mellemtilstande. De er meget mindre end de antistoffer, der findes naturligt i mennesker og de fleste andre organismer, men kan let fremstilles og modificeres i bakterier og andre celler.
Den anden funktion er afhængig af degrons, korte sekvenser i proteiner, der er ansvarlige for at regulere hastigheden af et proteins nedbrydning. Disse kan også tilpasses til at indstille udtømningen af et målprotein til de ønskede niveauer.
Når de kombineres som NanoDegs, de bliver en magtfuld, universel platform til modulering af cellulære proteinniveauer, sagde Segatori.
"I bund og grund, det giver os mulighed for at kontrollere den specifikke mængde proteiner i celler, " sagde hun. "Vi kan skræddersy det til at målrette ethvert protein i en celle, og når først den degron-mærkede nanobody binder sig til den partner, hele komplekset er nedbrudt.
"Fordelen ved dette system er, at det målretter ekspression på proteinniveau, " sagde Segatori. "Typisk, når folk ønsker at modulere mængden af proteiner i celler, de virker på DNA eller RNA – det genetiske – niveau. Men ved at handle på proteinniveau, vi kan målrette mod forskellige ændringer efter regulering, og meget vigtigere, vi har meget mere kontrol over hastigheden og omfanget af udtømning af proteinet."
Som et principbevis, forskerne designet et syntetisk genkredsløb, der udtrykte både grønt fluorescerende protein (GFP), som forskere bruger til at rapportere om cellulære processer, og en NanoDeg, der retter sig mod det. "Vi brugte GFP, fordi det er en almindeligt brugt reporter, og fluorescens er let at måle, " sagde Segatori. "Når nanobody genkender GFP, hele komplekset er taget for nedbrydning."
Det vil også være nyttigt for dem, der ønsker renere information om aktiviteterne af proteiner i celler.
"Sig du designer et genetisk kredsløb, hvor GFP-ekspression aktiveres, når cellen er under stress, som næringssult eller varme, for eksempel, " sagde Segatori. "Når cellen udsættes for stimulus, GFP udtrykkes, og du kan påvise en stigning i cellefluorescens.
"Men når du fjerner stimulus, henfaldet af signalet afspejler ikke nødvendigvis henfaldet af stimulus; det afspejler stabiliteten af GFP-reporteren, " sagde hun. "Det, vi har gjort, er at skabe et genkredsløb, hvor GFP-ekspression aktiveres under stimulus, men når stimulus er slået fra, NanoDeg nedbryder GFP meget hurtigt. Det øger følsomheden og den dynamiske opløsning af et syntetisk genkredsløb."
 Varme artikler
Varme artikler
-
 Fuglenes flyvehastighed er mere kompleks end tidligere antagetKredit:CC0 Public Domain Fuglenes flyvehastighed er mere kompleks, end forskning tidligere har formået at vise. I en ny undersøgelse fra Lunds Universitet i Sverige, forskere har fundet ud af, at
Fuglenes flyvehastighed er mere kompleks end tidligere antagetKredit:CC0 Public Domain Fuglenes flyvehastighed er mere kompleks, end forskning tidligere har formået at vise. I en ny undersøgelse fra Lunds Universitet i Sverige, forskere har fundet ud af, at -
 Eksotiske dyr og jagten på guldKredit:University of New Mexico Mænd, kvinder og deres familier ankom i stort tal til det nordlige Californien med drømmen om at blive rige i midten af det 19. århundrede. Hvad de fleste mennesk
Eksotiske dyr og jagten på guldKredit:University of New Mexico Mænd, kvinder og deres familier ankom i stort tal til det nordlige Californien med drømmen om at blive rige i midten af det 19. århundrede. Hvad de fleste mennesk -
 Hjælpere ved reden kan give moderfugle mulighed for at lægge mindre ægIfølge forskningen fra University of Cambridge, hunner i arter som den omgængelige væver har en tendens til at producere mindre æg, når der er hjælp til opdræt af afkom i forhold til, når forældre er
Hjælpere ved reden kan give moderfugle mulighed for at lægge mindre ægIfølge forskningen fra University of Cambridge, hunner i arter som den omgængelige væver har en tendens til at producere mindre æg, når der er hjælp til opdræt af afkom i forhold til, når forældre er -
 Hvordan toxoplasmose udnytter immunceller til at nå hjernenBilledet illustrerer Toxoplasma gondii tachyzoitter, der invaderer på tværs af cellemembranen i en værtscelle. Ved invasion, en signaleringskaskade aktiveres via kloridkanaler, GABA-kanaler og calci
Hvordan toxoplasmose udnytter immunceller til at nå hjernenBilledet illustrerer Toxoplasma gondii tachyzoitter, der invaderer på tværs af cellemembranen i en værtscelle. Ved invasion, en signaleringskaskade aktiveres via kloridkanaler, GABA-kanaler og calci
- Ingeniører leverer nye nøglekomponenter for at hjælpe med at drive et fusionsenergieksperiment
- Grønne bygninger skal gøre mere for at rette op på vores klimatilfælde
- Eukaryotisk celle: Definition, struktur og funktion (med analogi og diagram)
- Tandvedhæng taler om elgenes fremtrædende status i stenalderen
- GRACE-FO:Knækker en kold sag
- Langs en Minnesota-flod, is og sandart signalerer et klima i forandring


