Forskere identificerer, hvordan bakterien overlever i iltfattige miljøer

Biofilm er flercellede samfund dannet af tætpakkede mikrober, der ofte er forbundet med vedvarende infektioner. Stejle gradienter af næringsstoffer og ilt dannes i disse overfyldte strukturer. Det menneskelige patogen Pseudomonas aeruginosa producerer molekyler kaldet phenaziner, der hjælper det med at klare de iltbegrænsede forhold i biofilm. Columbia -forskere har afdækket nye roller for proteiner i elektrontransportkæden, der implicerer dem i udnyttelse af phenaziner. Kredit:Nicoletta Barolini, Columbia University
Columbia University biologer har afsløret en mekanisme, hvorved bakterieceller i overfyldte, iltfattige miljøer får adgang til ilt til energiproduktion, at sikre cellens overlevelse. Fundet kunne forklare, hvordan nogle bakterier, såsom Pseudomonas aeruginosa ( P. aeruginosa ), er i stand til at trives i iltfattige miljøer som biofilm og modstå antibiotika.
" P. aeruginosa biofilminfektioner er en førende dødsårsag for mennesker, der lider af cystisk fibrose, en genetisk tilstand, der påvirker lungerne og fordøjelsessystemet, " sagde hovedefterforsker Lars Dietrich, en lektor i biologiske videnskaber. "En forståelse af de veje, der bidrager til overlevelse og virulens af P. aeruginosa og andre bakterier, der er i stand til at eksistere i iltsultede miljøer, kunne informere behandlingsmetoder for mange af disse og andre immunkompromitterede patienter."
Undersøgelsen vises i denne uge i tidsskriftet eLife .
Bakterier lever sjældent af sig selv som encellede organismer. De fleste vokser i stedet i fællesskaber, udnyttelse af tallenes styrke til at danne en biofilm med vævslignende egenskaber svarende til et stillads, der tjener til at styrke samfundet, gør det op til 1, 000 gange mere resistent over for de fleste antibiotika.
Hver enkelt celle skal på egen hånd udvinde elektroner fra fødevarer, som derefter transporteres langs cellens membran, indtil de når et iltmolekyle. Den energi, der frigives under denne metaboliske proces, bruges til at opretholde livet. Efterhånden som bakteriesamfund fortsætter med at vokse og formes til en biofilm, imidlertid, de kan blive overfyldte, skabe et miljø, hvor hver celle skal konkurrere om begrænsede næringsstoffer og ilt for at overleve.
Forskning har vist, at nogle bakterier, inklusive P. aeruginosa , har udviklet forskellige strategier til at reagere på og klare de iltfattige forhold i biofilm. Bakteriesamfund kan bl. for eksempel, ændre biofilmens overordnede struktur, så forholdet mellem overfladeareal og volumen er højere, og en større andel af cellerne indeni kan få adgang til ilt på ydersiden. P. aeruginosa kan også lave molekyler kaldet fenaziner, som hjælper med at sende elektroner fra indersiden til ydersiden af cellen og i sidste ende til ilt tilgængeligt på afstand. En anden strategi er at lave alternative versioner af terminale oxidaser, enzymer i membranen, der overfører elektroner til oxygen, som bruger ilt mere effektivt eller er bedre til at opfange ilt, når dets koncentration er lav. Selvom der er blevet foretaget adskillige undersøgelser for at undersøge betydningen af disse enzymer og strategier for P. aeruginosa vækst, de er stort set blevet udført i veliltede flydende kulturer i laboratoriet. Hvornår P. aeruginosa inficerer en faktisk vært, som et menneske, den vokser ofte som en biofilm og møder vidt forskellige forhold.
Med føderal finansiering fra National Institutes of Health og National Science Foundation, Dietrich, første forfatter Jeanyoung Jo, og deres kolleger satte sig for bedre at forstå, om specifikke terminale oxidaser er vigtige for P. aeruginosa metabolisme i biofilmsamfund, hvordan phenaziner kan kompensere for lave iltniveauer, og hvordan disse tilpassede strategier kan bidrage til P. aeruginosa 's evne til at forårsage infektioner.
De fandt ud af, at elektrontransportkæden, der er så kritisk for omdannelsen af elektroner til energi, kan og fungerer dybt nede i den iltfattige biofilm, og at i disse miljøer, bakterien er afhængig af en bestemt del af kædens terminale oxidase – et protein kaldet CcoN4 – for at få adgang til ilt og vokse normalt. Celler, der mangler dette protein, overlever ikke så godt som celler med det, og forskerne mener derfor, at CcoN4 bidrager til bakteriens virulens. De fandt også, at CcoN4 spiller en rolle i at bruge phenaziner optimalt inden for biofilm. Selvom disse phenaziner tidligere har vist sig at metabolisk kompensere for iltfattige forhold i P. aeruginosa biofilm, mekanismen, der muliggjorde dette, var forblevet et videnskabeligt mysterium.
"Denne bakterie er en mester i at finde forskellige strategier for at få adgang til ilt, "Dietrich sagde." Vi vidste, at phenaziner var involveret, og at de på en eller anden måde hjalp cellen med at få ilt, men vi vidste ikke hvordan. Det ser ud til, at de kommer fra elektrontransportkæden. Det er en vigtig åbenbaring. Vi ved, at bakterieceller har forskellige måder at omsætte energi på i iltrige miljøer, men i længst tid kunne vi ikke finde ud af, hvordan de gjorde det, når ilt er svært tilgængeligt."
Fundene kan have store konsekvenser for behandlingen af P. aeruginosa biofilm infektioner, som en forståelse af de veje, der bidrager til P. aeruginosa overlevelse og virulens kunne være grundlaget for behandlingsmetoder for patienter. Udvikling af terapier, der blokerer CcoN4-holdige terminale oxidaser, for eksempel, ville svække bakterien og dens evne til at forårsage infektion.
"Vi begynder mere og mere at forstå, hvordan celler er i stand til at overleve under temmelig frygtelige omstændigheder, " sagde Dietrich. "Vi forstår mekanismen. Nu kan vi begynde at lede efter måder at lukke den proces på."
 Varme artikler
Varme artikler
-
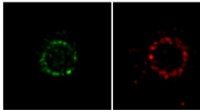 Lyser på bakteriel celledelingNanoskopiske billeder, der viser den rumlige organisering af to celledelingsproteiner i E. coli-celler. FtsZ (grøn) og FtsN (rød) er organiseret i plettede ringe på delingsstedet. Kredit:Okinawa Insti
Lyser på bakteriel celledelingNanoskopiske billeder, der viser den rumlige organisering af to celledelingsproteiner i E. coli-celler. FtsZ (grøn) og FtsN (rød) er organiseret i plettede ringe på delingsstedet. Kredit:Okinawa Insti -
 Loggede tropiske regnskove understøtter stadig biodiversitet, selv når varmen er tændtBornean Keeled Pit Viper. Kredit:University of Sheffield:Rebecca Senior Tropiske regnskove fortsætter med at buffer dyreliv fra ekstreme temperaturer, selv efter skovhugst, en ny undersøgelse har
Loggede tropiske regnskove understøtter stadig biodiversitet, selv når varmen er tændtBornean Keeled Pit Viper. Kredit:University of Sheffield:Rebecca Senior Tropiske regnskove fortsætter med at buffer dyreliv fra ekstreme temperaturer, selv efter skovhugst, en ny undersøgelse har -
 Hovedkomponenterne i skeletsystemetSkeletsystemet består af knogler, brusk, led og ledbånd. Selvom det hovedsagelig er knogle, omfatter hele systemet ca. 20 procent af menneskets kropsmasse. Hovedkomponenterne i skeletet er delt mellem
Hovedkomponenterne i skeletsystemetSkeletsystemet består af knogler, brusk, led og ledbånd. Selvom det hovedsagelig er knogle, omfatter hele systemet ca. 20 procent af menneskets kropsmasse. Hovedkomponenterne i skeletet er delt mellem -
 Invasive frøer giver invasive fugle et løft på HawaiiCoquis blev introduceret til Hawaii fra Puerto Rico i 1980erne og kan give et boost til øernes invasive fugle. Kredit:R. Choi Puerto Ricanske coqui frøer blev ved et uheld introduceret til Hawaii
Invasive frøer giver invasive fugle et løft på HawaiiCoquis blev introduceret til Hawaii fra Puerto Rico i 1980erne og kan give et boost til øernes invasive fugle. Kredit:R. Choi Puerto Ricanske coqui frøer blev ved et uheld introduceret til Hawaii
- Astronomer kigger ind i et sort hul for første gang med det nye Event Horizon-teleskop
- Meget effektiv hydrogengasproduktion ved hjælp af sollys, vand og hæmatit
- At skabe rum i loven til ikke-binære køn
- Forskere finder molekylære mønstre, der kan hjælpe med at identificere udenjordisk liv
- Australien er tilbage i satellitbranchen med en ny lancering
- Teenagere undgår lektier til sociale medier og videospil


