Genetiske instruktioner fra mor satte mønsteret for embryonal udvikling
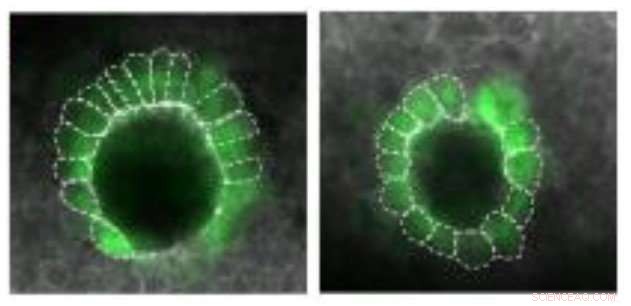
Et organ kaldet Kupffers vesikel, som hjælper med at specificere venstre og højre side af den udviklende fisk, er asymmetrisk formet i et vildtypeembryo (til venstre), men er mere symmetrisk i fravær af maternelt nedarvet gdf3 (højre). Kredit:Pelliccia et al., 2017
En ny undersøgelse indikerer en væsentlig rolle for et maternelt nedarvet gen i embryonal udvikling. Undersøgelsen viste, at zebrafisk, der ikke kunne arve specifikke genetiske instruktioner fra mor, udviklede dødelige defekter tidligere i udviklingen, selvom fiskene kunne lave deres egen version af genet. Undersøgelsen af forskere ved Princeton University blev offentliggjort 15. november i tidsskriftet eLife .
Når hundyr danner ægceller inde i deres æggestokke, de deponerer messenger -RNA'er (mRNA'er) - en slags genetisk instruktionssæt - i ægcellecytoplasma. Efter befrugtning, disse maternelt leverede mRNA'er kan oversættes til proteiner, der er nødvendige for de tidlige stadier af embryonal udvikling, før embryoet er i stand til at producere sine egne mRNA'er og proteiner.
For mere end tredive år siden, forskere opdagede, at mRNA'er, der koder for et protein kaldet Vg1, afsættes i frøægs cytoplasma. "vg1 er berømt for at være en af de første anerkendte moder -mRNA'er, "sagde Rebecca Burdine, lektor i molekylærbiologi ved Princeton. "Der er skrevet et væld af papirer om, hvordan dette RNA er lokaliseret og reguleret, men det var aldrig klart, hvad Vg1 -proteinet egentlig gør i det udviklende embryo. "
I undersøgelsen, Burdine og to kandidatstuderende Jose Pelliccia og Granton Jindal brugte CRISPR/Cas9 genredigering til at fjerne Vg1, kendt som Gdf3 i zebrafisk. Embryoner, der ikke kunne producere deres egne Gdf3 - men modtog en sund del af gdf3 mRNA fra deres mødre - udviklede sig helt normalt. Men embryoner, der ikke modtog moderns gdf3 mRNA, viste store defekter tidligt i deres udvikling, dør kun tre dage efter befrugtningen.
"Hvis gdf3 ikke leveres til ægget af moderen, det befrugtede æg kan ikke producere to af de tre hovedtyper af celler, der kræves til udvikling, "Burdine sagde." Embryonerne mangler alle [celletyper kendt som] mesoderm og endoderm og sidder tilbage med hud og noget neuralt væv, [som stammer fra den tredje større celletype, ektodermen]. "
Vg1/Gdf3 er medlem af TGF-beta-familien af cellesignalmolekyler. To andre medlemmer af denne familie, Ndr1 og Ndr2, er nødvendige for at danne mesoderm og endoderm tidligt i zebrafiskudviklingen. Embryoner, der mangler gdf3 fra moderen, ligner meget embryoner, der mangler begge disse proteiner, som er analoge med Nodal 1 og 2 proteiner i pattedyr.
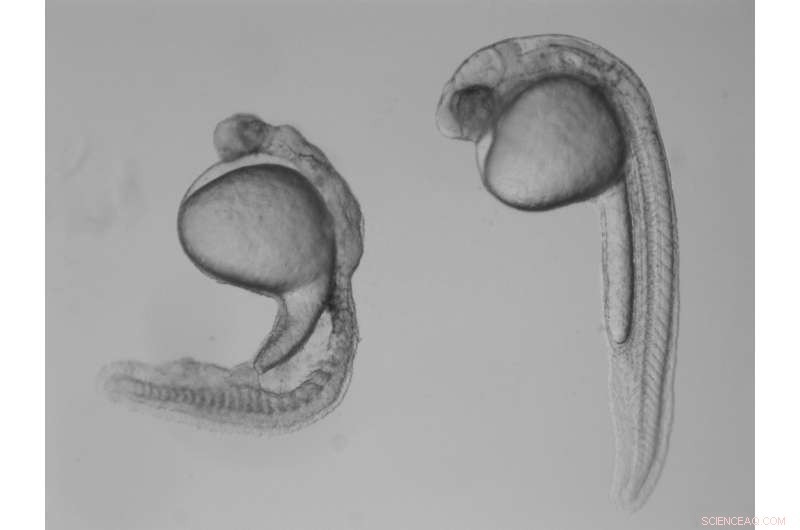
Sammenlignet med et normalt zebrafiskembryo (højre), et embryo, der mangler gdf3 (til venstre) arvet fra mor, viser store defekter som følge af dets manglende evne til at danne mesoderm og endodermceller tidligt i udviklingen. Kredit:Pelliccia et al., 2017.
Forskerne fandt ud af, at moderens gdf3 er påkrævet for Ndr1 og Ndr2 for at signalere på de niveauer, der er nødvendige for korrekt at inducere dannelsen af mesoderm og endodermceller i tidlige zebrafiskembryoner. I mangel af gdf3, Ndr1 og Ndr2 signalering reduceres dramatisk, og embryonisk udvikling går galt.
Nodal signalering er også påkrævet senere i zebrafiskudviklingen, når det hjælper med at fastslå forskelle mellem venstre og højre side af det udviklende embryo. Det gør dette, delvis, ved at styre dannelsen af et organ kendt som Kupffers vesikel, hvis asymmetriske form hjælper med at bestemme embryoets venstre og højre side. Efterfølgende, Nodal signalering inducerer ekspression af et tredje Nodal protein, kaldet southpaw, i en gruppe mesodermceller på venstre side af embryoet.
For at undersøge, om moderat leveret gdf3 mRNA også spiller en rolle i venstre-højre mønster, forskerne brugte en række eksperimentelle tricks til at forsyne embryoner med nok Gdf3 -protein til at danne mesoderm og endoderm og overleve indtil de senere stadier af embryonal udvikling.
Som forudsagt, disse embryoner viste defekter i venstre-højre mønster. Deres Kupffers vesikler var unormalt symmetriske i form, og Southpaw -udtrykket blev stærkt reduceret, hvilket tyder på, at gdf3 også er påkrævet for optimal Nodal -signalering i senere stadier af embryonal udvikling. På dette tidspunkt, imidlertid, embryonisk gdf3 ser ud til at være i stand til at udføre jobbet, hvis gdf3 fra moderen er fraværende.
Nodal- og Vg1 -proteiner vides at binde til hinanden i andre arter. "Dermed, vi antager, at Gdf3 kombineres med Ndr1 og Ndr2 for at lette Nodal -signalering under zebrafiskudvikling, fungerer som en væsentlig faktor i embryonisk mønster, "sagde Pelliccia, en kandidatstuderende i molekylærbiologi. Medforfatter Jindal fik sin ph.d. i kemisk og biologisk teknik i 2017.
På samme tid som Burdine og kolleger, to andre forskningsgrupper, ledet af Joe Yost ved University of Utah og Alex Schier ved Harvard University, gjort lignende fund om gdf3's rolle under zebrafiskudvikling. "Alle tre grupper arbejdede sammen for at co-indsende og co-publicere i eLife , lade de involverede studerende alle få æren for deres hårde arbejde, "Sagde Burdine." Det er et godt eksempel på, hvordan videnskab skal gøres. "
 Varme artikler
Varme artikler
-
 Trænede høge skræmmer mindre fugle, tegne stirrer i LAI denne 7. april, 2017 foto Dany a Harriss hawk holder øje med eventuelle irriterende fugle under en arbejdsdag på Museum of Modern Art i Los Angeles. Kendt som The Hawk Pros. mand-og-hustru falkoner
Trænede høge skræmmer mindre fugle, tegne stirrer i LAI denne 7. april, 2017 foto Dany a Harriss hawk holder øje med eventuelle irriterende fugle under en arbejdsdag på Museum of Modern Art i Los Angeles. Kendt som The Hawk Pros. mand-og-hustru falkoner -
 Genopretning af havpattedyr fra vestkysten øger forbruget af chinook laksKredit:CC0 Public Domain Genvinding af bestande af spækhugger, søløver og spættet sæler på vestkysten har dramatisk øget deres forbrug af chinook laks i de sidste 40 år, som nu kan overstige den k
Genopretning af havpattedyr fra vestkysten øger forbruget af chinook laksKredit:CC0 Public Domain Genvinding af bestande af spækhugger, søløver og spættet sæler på vestkysten har dramatisk øget deres forbrug af chinook laks i de sidste 40 år, som nu kan overstige den k -
 At handle eller ikke at handle? At bryde elfenbenslåsenElefant nær Kruger National Park. Kredit:Duan Biggs Debatten om, hvorvidt lovlig handel med elfenben skal have lov til at finansiere bevarelse af elefanter, eller helt forbudt at stoppe krybskytte
At handle eller ikke at handle? At bryde elfenbenslåsenElefant nær Kruger National Park. Kredit:Duan Biggs Debatten om, hvorvidt lovlig handel med elfenben skal have lov til at finansiere bevarelse af elefanter, eller helt forbudt at stoppe krybskytte -
 Ormearter mistede 7, 000 gener efter at have udviklet sig til at befrugte sig selvUMD-ledet undersøgelse viser, at orme, der befrugter sig selv, mistede en fjerdedel af deres genom, herunder gener, der gør sæden konkurrencedygtig. Reproduktion hos de fleste dyrearter kræver avl me
Ormearter mistede 7, 000 gener efter at have udviklet sig til at befrugte sig selvUMD-ledet undersøgelse viser, at orme, der befrugter sig selv, mistede en fjerdedel af deres genom, herunder gener, der gør sæden konkurrencedygtig. Reproduktion hos de fleste dyrearter kræver avl me
- Pennsylvania afslører cyberindtrængen i fødslen, dødsrapporter
- Chancen for at finde unge jordlignende planeter højere end tidligere antaget
- Kosmiske magnetfelter med forbløffende orden
- Streaming til abonnementer:Videospil går ind i nye grænser
- Beregningsundersøgelse afslører, hvordan ebola-nukleocapsid stabiliserer sig
- Gamle proteiner hjælper med at spore tidlig mælkedrik i Afrika


