Hjernecellerne, der bremser os, når de var syge
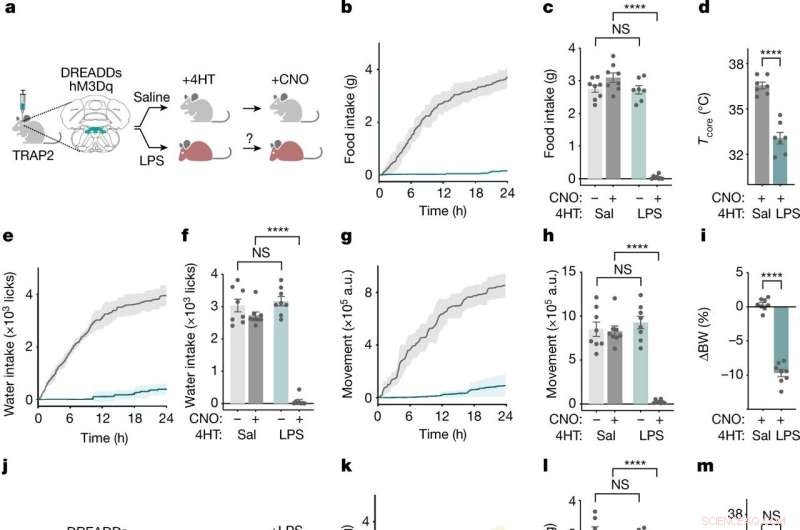
NTS-AP neuroner regulerer sygdomsadfærd. a , Metode til TRAP2-mærkning og reaktivering af NTS-AP-neuroner ved hjælp af aktiverende hM3Dq (Gq) DREADD'er. Grå mus, normal; rød mus, syg. b ,e ,g , Kumulativt fødeindtag (b ), vandindtag (e ) og bevægelse (g ) i 24 timer efter reaktivering af saltvandsmærkede (grå) og LPS-mærkede (cyan) neuroner. c ,f ,h , Fødeindtag (c ) (ANOVA P < 1 × 10 −7 ), vandindtag (f ) (ANOVA P < 1 × 10 −7 ) og bevægelse (h ) (ANOVA P < 1 × 10 −7 ) 12 timer efter CNO-injektion til reaktivering af saltvandsmærkede (mørkegrå) og LPS-mærkede (mørkcyan) neuroner; saltvandskontroller for CNO-administration er også vist (lysegrå; lys cyan). d ,i , Ændring i kernetemperatur (uparret t -test P = 4,6 × 10 −6 ) 4 t efter genaktivering (d ) og kropsvægt i procent (uparret t -test P < 1 × 10 −7 ) 24 t efter genaktivering (i ) af saltvandsmærkede (grå) og LPS-mærkede (cyan) neuroner. I alle paneler, saltvandsmærkede dyr, n = 8; LPS-mærkede dyr, n = 7. j , Skematisk af TRAP2-mærkning og inaktivering under anvendelse af hæmmende hM4Di (Gi) DREADD'er under samtidig LPS-eksponering. k ,n ,p , Kumulativt fødeindtag (k ), vandindtag (n ) og bevægelse (p ) i 24 t efter CNO-baseret hæmning og samtidig LPS-behandling (0,5 mg kg −1 , i.p.) af saltvandsmærkede (grå) og LPS-mærkede (mørkegule) neuroner. Saltvandsbehandling af LPS-mærkede neuroner (lysegul) vist til reference. l ,o ,q , Fødeindtag (l ) (ANOVA P = 2,9 × 10 −7 ), vandindtag (o ) (ANOVA P = 2,1 × 10 −7 ) og bevægelse (g ) (ANOVA P = 3,3 × 10 −4 ) 12 timer efter inhibering og samtidig LPS-behandling (0,5 mg kg −1 , i.p.) af saltvandsmærkede (mørkegrå) og LPS-mærkede (mørkegule) neuroner; saltvandskontroller til CNO-administration er også vist (lysegrå; lysegul). m ,r , Ændring i kernetemperatur (uparret t -test, NS) 4 t efter (m ) og kropsvægt i procent (uparret t -test, P = 3,2 × 10 −5 ) 24 t efter (r ) hæmning og samtidig LPS-behandling af saltvandsmærkede (grå) og LPS-mærkede (gule) neuroner. I alle paneler, saltvandsmærkede dyr, n = 7; LPS-mærkede dyr, n = 7. ***P <0,001, ****P <0,0001 og NS, ikke signifikant (P> 0,05). Alle fejlbjælker repræsenterer s.e.m. Kredit:Nature (2022). DOI:10.1038/s41586-022-05161-7
Vi er tilbøjelige til at spise, drikke og bevæge os mindre, når vi har det dårligt med vejret. Og vi er ikke alene - de fleste dyr reducerer de samme tre adfærdsmønstre, når de kæmper mod en infektion.
Nu peger en ny undersøgelse på den klynge af neuroner, der kontrollerer disse reaktioner, kaldet sygdomsadfærd. Ved at fremkalde immunreaktioner hos mus viste forskere, at en specifik population af celler i hjernestammen potent inducerer tre afslørende sygdomsadfærd. Derudover sløver inhibering af disse neuroner hvert af disse adfærdselementer i sygdomsreaktionen. Resultaterne, offentliggjort i Nature , forbinder inflammation direkte med neurale veje, der regulerer adfærd, og giver indsigt i, hvordan immunsystemet interagerer med hjernen.
"Vi er stadig i de tidlige dage, hvor vi forsøger at forstå hjernens rolle i infektion," siger Jeffrey M. Friedman, Marilyn M. Simpson-professor ved Rockefeller University. "Men med disse resultater har vi nu en unik mulighed for at spørge:Hvordan ser din hjerne ud, når du er syg?"
Sygdomsadfærd har vist sig at spille en vigtig rolle i et dyrs helbredelse efter en infektion. Tidligere undersøgelser har styrket denne teori ved at påvise, at dyr, der blev tvunget til at spise, når de er syge, viste en signifikant øget dødelighed. "Disse adfærdsændringer under infektion er virkelig vigtige for overlevelse," siger hovedforfatter Anoj Ilanges, en tidligere kandidatstuderende i Friedmans laboratorium, nu gruppeleder på HHMI Janelia Research Campus
Men det har aldrig været klart, hvordan hjernen koordinerer den nærmest universelle trang til at nægte måltider og krølle sig sammen under dynen, når infektionen begynder. Så Friedman og Ilanges satte sig for at kortlægge hjerneområderne bag sygdomsadfærd hos mus.
Holdet begyndte med at udsætte mus for LPS, et stykke bakteriel cellevæg, der aktiverer immunsystemet og potent inducerer sygdomsadfærd. Kort efter en injektion af LPS var der en stigning i aktiviteten i en hjernestammeregion kendt som det dorsale vagale kompleks, blandt en population af neuroner, der udtrykker neuropeptidet ADCYAP1. For at bekræfte, at de havde fundet de rigtige hjerneceller, aktiverede forskerne derefter disse neuroner i raske mus, og de fandt ud af, at dyrene spiste, drak og bevægede sig mindre. I modsætning hertil, da ADCYAP1-neuronerne blev deaktiveret, blev effekten af LPS på disse adfærd reduceret signifikant.
"Vi vidste ikke, om de samme eller forskellige neuroner regulerede hver af disse adfærd," siger Friedman, "Vi fandt det overraskende, at en enkelt neuronal population ser ud til at regulere hver af disse komponenter i sygdomsreaktionen."
Forfatterne var dog ikke helt overraskede over, at denne hjernestammeregion var involveret i at formidle sygdomsadfærd. Det dorsale vagale kompleks er et af få dyrebare fysiologiske vejkryds i centralnervesystemet, hvor et fravær af blod-hjernebarrieren gør det muligt for cirkulerende faktorer i blodet at videregive information direkte til hjernen. "Denne region er opstået som en slags alarmcentral for hjernen, der formidler information om afersive eller skadelige stoffer, som oftere end ikke reducerer fødeindtagelsen," siger Friedman.
I de kommende måneder har Friedmans team hos Rockefeller til hensigt at inkorporere disse resultater i deres overordnede mål om at forstå de fysiologiske signaler og neurale kredsløb, der regulerer fodringsadfærd. De er specielt interesserede i at forstå, hvorfor selv mus, der er udviklet til at spise glubsk, alligevel vil holde op med at spise, når de udsættes for bakterielle infektioner.
I mellemtiden planlægger Ilanges at undersøge, hvilken rolle andre hjerneregioner spiller som reaktion på infektioner, og udvide vores viden om hjernens rolle under denne kritiske proces. "Vi kiggede på en region af hjernen, men der er mange andre, der bliver aktiveret med immunresponset," siger han. "Dette åbner døren til at spørge, hvad hjernen gør, holistisk, under infektion." + Udforsk yderligere
Neuroner i hjernestammen, der regulerer sygdomssymptomer fundet i musemodel
 Varme artikler
Varme artikler
-
 Nobelpris:Svante Pääbos gamle DNA-opdagelser giver fingerpeg om, hvad der gør os til menneskerPääbos opdagelser viser os, at gensekvenser fra vores uddøde slægtninge påvirker nutidens menneskers fysiologi. Kredit:Gorodenkoff/Shutterstock Nobelprisen i fysiologi eller medicin for 2022 er ble
Nobelpris:Svante Pääbos gamle DNA-opdagelser giver fingerpeg om, hvad der gør os til menneskerPääbos opdagelser viser os, at gensekvenser fra vores uddøde slægtninge påvirker nutidens menneskers fysiologi. Kredit:Gorodenkoff/Shutterstock Nobelprisen i fysiologi eller medicin for 2022 er ble -
 Planter kan forsvare sig selv ved at få larver til at dreje kannibalEN Helicoverpa armígera larve fotograferet oven på et jordbær. Ny forskning observerede det samme Spodoptera exigua larver vender sig til kannibalisme efter at have stødt på en bestemt forbindelse
Planter kan forsvare sig selv ved at få larver til at dreje kannibalEN Helicoverpa armígera larve fotograferet oven på et jordbær. Ny forskning observerede det samme Spodoptera exigua larver vender sig til kannibalisme efter at have stødt på en bestemt forbindelse -
 Sådan fungerer placebo -effektenEr det det, du er kommet for? Få fakta om stoffer med flere stofbilleder. © iStockphoto.com/VisualField De fleste af os går kun til lægen, når vi ikke har det godt. Du læser gamle blade i venteværels
Sådan fungerer placebo -effektenEr det det, du er kommet for? Få fakta om stoffer med flere stofbilleder. © iStockphoto.com/VisualField De fleste af os går kun til lægen, når vi ikke har det godt. Du læser gamle blade i venteværels -
 Et ikke -vanedannende opioid smertestillende middel uden bivirkningerResultaterne viser, hvordan USC Michelson Center -forskere samarbejder med andre eksperter inden for flere discipliner for at udføre banebrydende forskning. Kredit:Janels Katlaps Hvad hvis forsker
Et ikke -vanedannende opioid smertestillende middel uden bivirkningerResultaterne viser, hvordan USC Michelson Center -forskere samarbejder med andre eksperter inden for flere discipliner for at udføre banebrydende forskning. Kredit:Janels Katlaps Hvad hvis forsker
- Machine learning driver selvkørende tilgang fra Wayve
- Naturlig geologisk metan-emission ser ud til at være større end forventet
- Strækbart, nedbrydelige halvledere
- Hvordan virksomheder kan overvinde paradokset med beredskab
- NASA ser en organiseret orkan Helene nær Afrika
- Faktorer der påvirker væksten af mikroorganismer


