Hvordan proteinaggregering sker i celler
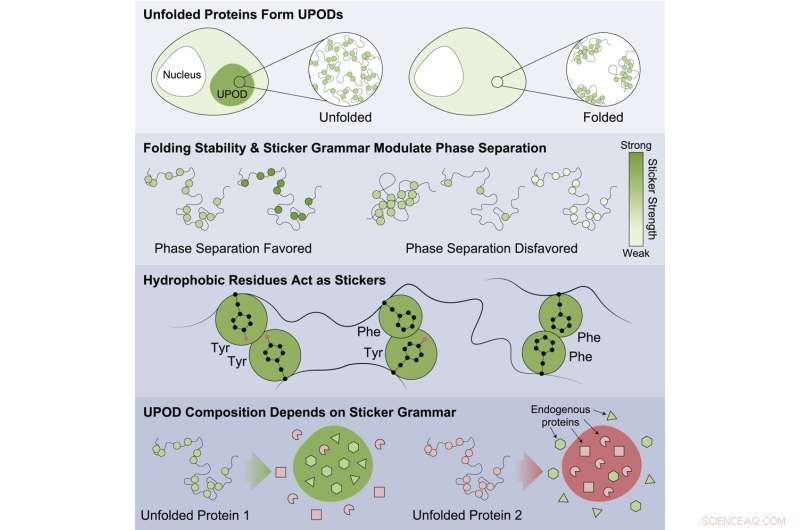
Grafisk abstrakt. Kredit:Molecular Cell (2022). DOI:10.1016/j.molcel.2022.06.024
Udgivet i Molecular Cell journal den 19. juli viste en forskningsundersøgelse fra Hatters Laboratory, at uhensigtsmæssig proteinaggregering er forbundet med dårlige resultater for cellesundhed og overlevelse - især i neuroner i neurodegenerative sygdomme.
Undersøgelsen undersøgte de molekylære drivkræfter, der får fejlfoldede proteiner til at klæbe sammen unormalt og så på virkningen af klæbrige proteiner på de omgivende proteiner i en celle, specifikt hvordan proteostasesystemer detekterer disse klæbrige proteiner for at forhindre dem i at aggregere.
Forskningen er et resultat af et samarbejde mellem professor Rohit Pappu ved Washington University, forskere fra University of Melbourne, herunder Ph.D. studerende og ligestillet førsteforfatter, Yoon Hee Choi, professor David Ascher, Dr. Dezerae Cox og Angelique Haynes og forskere fra University of Leeds.
"Vi fandt ud af, at der var særlige proteiner, der normalt regulerer proteinfoldning - kaldet molekylære chaperoner - som er meget specifikke til at detektere bestemte klistermærkemønstre. Dette er et vigtigt fund, da det informerer om, hvordan celler registrerer, når proteiner aggregeres unormalt," sagde professor Hatters.
Proteiner er fundamentale for cellernes funktion og celleoverlevelse, og proliferation kræver, at proteiner folder og binder andre proteiner.
"Når proteiner ikke folder ordentligt, kan mellemliggende 'fejlfoldede' former - kendt som udfoldede proteinaflejringer (UPOD'er) - klæbe sammen til aggregater. Sådanne aggregater opstår i mange sygdomsmiljøer, når de molekylære systemer, der styrer proteinfoldning og clearance 'proteostase' ' bryde sammen," sagde Choi.
Undersøgelsen fremhævede proteiner, der var mindre stabile, var mere tilbøjelige til at aggregere og være forbundet med sygdom. Resultater tyder på, at dette sker gennem den uhensigtsmæssige aggregering af forkert foldede former med forskellige underenheder, der registrerer forskellige "mærke"-koder, der styrer aggregeringen. Proteinerne er involveret i en lang række sygdomme, herunder kræftformer, medfødte lidelser, nervesystemsygdomme, stofskifteforstyrrelser og hudsygdomme.
Der blev fundet specifikke mønstre af klistermærker, som var vigtige for at dirigere aggregering, og som forårsagede, at andre omgivende tilstedeværende proteiner i cellen blev co-aggregeret. Arbejdet viste, at visse klasser af aminosyrer var de bedste klistermærker – tyrosin og phenylalanin – og at mønsteret af aminosyrerne var vigtigt for, hvordan tilstedeværende proteiner blev uhensigtsmæssigt co-aggregeret, og hvordan molekylære chaperoner genkendte de aggregater, der dannedes.
"Det næste skridt er at forstå mekanismerne bag dette bedre. Dette kan være nyttigt i fremtidige bestræbelser på at omprogrammere celler til bedre at rydde ud af proteinaggregater, såsom i sygdomme, hvor de akkumuleres i vid udstrækning," sagde professor Hatters.
 Varme artikler
Varme artikler
-
 Mongolske mikrofossiler peger på dyrenes stigning på JordenAssorterede mikrofossiler fra Ediacaran Khesen-formationen, Mongoliet. Hvert fossil er i størrelsesordenen 200 mikron maksimal dimension. Kredit:Yale University Et Yale-ledet forskerhold har opdag
Mongolske mikrofossiler peger på dyrenes stigning på JordenAssorterede mikrofossiler fra Ediacaran Khesen-formationen, Mongoliet. Hvert fossil er i størrelsesordenen 200 mikron maksimal dimension. Kredit:Yale University Et Yale-ledet forskerhold har opdag -
 Skal du spise det? Undersøgelse afslører hundeafføring er en væsentlig del af ræves kostEn undersøgelse analyserede røde ræves kost. Kredit:University of Aberdeen En undersøgelse, der analyserede røde ræves kost i det skotske højland, har fundet ud af, at hundeafføring er en væsentlig
Skal du spise det? Undersøgelse afslører hundeafføring er en væsentlig del af ræves kostEn undersøgelse analyserede røde ræves kost. Kredit:University of Aberdeen En undersøgelse, der analyserede røde ræves kost i det skotske højland, har fundet ud af, at hundeafføring er en væsentlig -
 Hunde plejede at snuse ud sjældne arterEmma Bennett med sine hunde. Kredit:Monash University En ny undersøgelse har fundet ud af, at hunde i høj grad kan hjælpe bevarelsesindsatsen med at finde sjældne arter ved at lugte deres poo. Hu
Hunde plejede at snuse ud sjældne arterEmma Bennett med sine hunde. Kredit:Monash University En ny undersøgelse har fundet ud af, at hunde i høj grad kan hjælpe bevarelsesindsatsen med at finde sjældne arter ved at lugte deres poo. Hu -
 25 nye genomer for at fejre 25 års Sanger InstituttetKredit:CC0 Public Domain For at fejre Wellcome Trust Sanger Institute, der fylder 25 i 2018, Instituttet og dets samarbejdspartnere sekventerer 25 nye genomer. Fra brombær til robin, bush cricket
25 nye genomer for at fejre 25 års Sanger InstituttetKredit:CC0 Public Domain For at fejre Wellcome Trust Sanger Institute, der fylder 25 i 2018, Instituttet og dets samarbejdspartnere sekventerer 25 nye genomer. Fra brombær til robin, bush cricket
- Cross-country undersøgelse ser på social integration blandt minoritetsunge
- Raffinerede materialer giver et boosterskud til solenergikonvertering
- Forskere forbedrer metoden til at sondere halvledende krystaller med lys for at opdage defekter og u…
- Vind, regnslag vestlige Indien, da cyklonen vender væk
- Toyota skal teste solpaneler til elbiler
- Undersøgelse tackler skillet over NFL -spilleres protester


