Nyt antibiotikum dræber patogene bakterier, skåner sunde tarmmikrober
Forskere har udviklet et nyt antibiotikum, der reducerede eller eliminerede lægemiddelresistente bakterieinfektioner i musemodeller af akut lungebetændelse og sepsis, mens de skånede sunde mikrober i musetarmen. Lægemidlet, kaldet lolamicin, afværgede også sekundære infektioner med Clostridioides difficile, en almindelig og farlig hospitalsassocieret bakterieinfektion, og var effektiv mod mere end 130 multiresistente bakteriestammer i cellekultur.
Resultaterne er detaljeret beskrevet i tidsskriftet Nature .
"Folk begynder at indse, at de antibiotika, vi alle har taget - som bekæmper infektion og i nogle tilfælde redder vores liv - også har disse skadelige virkninger på os," sagde University of Illinois Urbana-Champaign kemiprofessor Paul Hergenrother, der ledede undersøgelsen sammen med tidligere doktorand Kristen Muñoz.
"De dræber vores gode bakterier, mens de behandler infektionen. Vi ønskede at begynde at tænke på den næste generation af antibiotika, der kunne udvikles til at dræbe de patogene bakterier og ikke de gavnlige."
Adskillige undersøgelser har fundet ud af, at antibiotika-relaterede forstyrrelser i tarmmikrobiomet øger sårbarheden over for yderligere infektioner og er forbundet med mave-tarm-, nyre-, lever- og andre problemer.
"De fleste klinisk godkendte antibiotika dræber kun gram-positive bakterier eller dræber både gram-positive og gram-negative bakterier," sagde Muñoz.
Gram-positive og gram-negative bakterier adskiller sig i sammensætningen af deres cellevægge. Gram-negative bakterier har et dobbelt lag af beskyttelse, hvilket gør dem sværere at dræbe, sagde Muñoz.
De få lægemidler, der er tilgængelige til at bekæmpe gram-negative infektioner, dræber også andre potentielt gavnlige gram-negative bakterier. For eksempel kan colistin, et af de få gram-negative antibiotika, der er godkendt til klinisk brug, forårsage C. difficile-associeret diarré og pseudomembranøs colitis, en potentielt livstruende komplikation. Lægemidlet har også toksiske virkninger på lever og nyrer, og "således bliver colistin typisk kun brugt som et antibiotikum i sidste instans," skrev forskerne.

For at tackle de mange problemer, der er forbundet med vilkårlig målretning mod gram-negative bakterier, fokuserede holdet på en række lægemidler udviklet af medicinalfirmaet AstraZeneca. Disse lægemidler hæmmer Lol-systemet, et lipoprotein-transportsystem, der er eksklusivt for gram-negative bakterier og genetisk forskelligt i patogene og gavnlige mikrober.
Disse lægemidler var ikke effektive mod gram-negative infektioner, medmindre forskerne først underminerede vigtige bakterielle forsvar i laboratoriet. Men fordi disse antibiotika så ud til at skelne mellem gavnlige og patogene gram-negative bakterier i cellekultureksperimenter, var de lovende kandidater til yderligere udforskning, sagde Hergenrother.
I en række eksperimenter designede Muñoz strukturelle variationer af Lol-hæmmere og evaluerede deres potentiale til at bekæmpe gram-negative og gram-positive bakterier i cellekultur.
En af de nye forbindelser, lolamicin, målrettede selektivt nogle "laboratoriestammer af gram-negative patogener, herunder Escherichia coli, Klebsiella pneumoniae og Enterobacter cloacae," fandt forskerne. Lolamicin havde ingen påviselig effekt på gram-positive bakterier i cellekultur. Ved højere doser dræbte lolamicin op til 90 % af multiresistente E. coli, K. pneumoniae og E. cloacae kliniske isolater.
Når det blev givet oralt til mus med lægemiddelresistent septikæmi eller lungebetændelse, reddede lolamicin 100 % af musene med blodforgiftning og 70 % af musene med lungebetændelse, rapporterede holdet.
Der blev udført et omfattende arbejde for at bestemme virkningen af lolamicin på tarmmikrobiomet.
"Musemikrobiomet er et godt værktøj til at modellere menneskelige infektioner, fordi menneskets og musens tarmmikrobiomer er meget ens," sagde Muñoz. "Undersøgelser har vist, at antibiotika, der forårsager tarmdysbiose hos mus, har en lignende virkning hos mennesker."
Behandling med standard antibiotika amoxicillin og clindamycin forårsagede dramatiske skift i den overordnede struktur af bakteriepopulationer i musetarmen, hvilket mindskede mængden af flere gavnlige mikrobielle grupper, fandt holdet.
"I modsætning hertil forårsagede lolamicin ingen drastiske ændringer i den taksonomiske sammensætning i løbet af den tre-dages behandling eller den følgende 28-dages genopretning," skrev forskerne.
Mange flere års forskning er nødvendige for at udvide resultaterne, sagde Hergenrother. Lolamicin eller andre lignende forbindelser skal testes mod flere bakteriestammer, og der skal udføres detaljerede toksikologiske undersøgelser. Enhver ny antibiotika skal også vurderes for at bestemme, hvor hurtigt de inducerer lægemiddelresistens, et problem, der før eller siden opstår hos bakterier behandlet med antibiotika.
Undersøgelsen er et proof-of-concept, at antibiotika, der dræber en patogen mikrobe og samtidig skåner gavnlige bakterier i tarmen, kan udvikles til gram-negative infektioner - nogle af de mest udfordrende infektioner at behandle, sagde Hergenrother.
Flere oplysninger: Paul Hergenrother, et gramnegativt-selektivt antibiotikum, der skåner tarmmikrobiomet, Nature (2024). DOI:10.1038/s41586-024-07502-0. www.nature.com/articles/s41586-024-07502-0
Journaloplysninger: Natur
Leveret af University of Illinois at Urbana-Champaign
 Varme artikler
Varme artikler
-
 EU's handelsforbud bringer den globale handel med vilde fugle ned med 90 procentDen populære kæledyrsfugl, kanariefuglen med gul front, var en af de mest handlede vilde fugle før EUs handelsforbud mod vilde fugle i 2005. I dag de mest handlede vilde fugle globalt er papegøjer.
EU's handelsforbud bringer den globale handel med vilde fugle ned med 90 procentDen populære kæledyrsfugl, kanariefuglen med gul front, var en af de mest handlede vilde fugle før EUs handelsforbud mod vilde fugle i 2005. I dag de mest handlede vilde fugle globalt er papegøjer. -
 Forskere aflytter lidt kendte næbhvaler for at lære, hvor dybt de dykkerGervais næbhval. Kredit:NOAA Fisheries/Southeast Fisheries Science Center Forskere har rapporteret de første dykkedybder for Gervais og Trues næbhvaler, to af de mindst kendte næbhvalarter kendt s
Forskere aflytter lidt kendte næbhvaler for at lære, hvor dybt de dykkerGervais næbhval. Kredit:NOAA Fisheries/Southeast Fisheries Science Center Forskere har rapporteret de første dykkedybder for Gervais og Trues næbhvaler, to af de mindst kendte næbhvalarter kendt s -
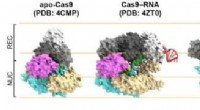 Genteknisk mekanisme visualiseretFigur 1. Strukturer af Cas9. Fra venstre til højre:Cas9 alene (apo-Cas9), Cas9 bundet til RNA (Cas9 – RNA), Cas9 – RNA bundet til sit enkeltstrengede DNA-mål (Cas9 – RNA – DNA), Cas9 – RNA bundet til
Genteknisk mekanisme visualiseretFigur 1. Strukturer af Cas9. Fra venstre til højre:Cas9 alene (apo-Cas9), Cas9 bundet til RNA (Cas9 – RNA), Cas9 – RNA bundet til sit enkeltstrengede DNA-mål (Cas9 – RNA – DNA), Cas9 – RNA bundet til -
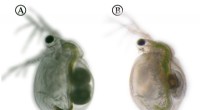 Hvordan vandlopper forsvarer sig mod kødædende planterDafnier, der vokser i nærvær af Utricularia (til højre) har en lidt anden morfologi end dem, der ikke lever sammen med planten (til venstre). Forskellene er dog næsten usynlige for det blotte øje. Kre
Hvordan vandlopper forsvarer sig mod kødædende planterDafnier, der vokser i nærvær af Utricularia (til højre) har en lidt anden morfologi end dem, der ikke lever sammen med planten (til venstre). Forskellene er dog næsten usynlige for det blotte øje. Kre
- Opdagelse af nul-energi bundne tilstande i begge ender af en endimensionel atomlinjefejl
- Kan øjne på selvkørende biler reducere antallet af ulykker?
- Billede:Hubble fanger en galakse, to asteroider
- Dawn mission for at indsamle flere data i hjemmet stretch
- Hvilke af de følgende gasser ville have mest som en ideel gas: Han, NH3, Cl2 eller CO2?
- NASAs infrarøde syn afslører den tropiske cyklon Halehs magt


