Mysteriet CRISPR låst op:En ny allieret mod antibiotikaresistens?
CRISPR-Cas-systemer har revolutioneret bioteknologien ved at tilbyde måder at redigere gener på som en programmerbar saks. I naturen bruger bakterier disse systemer til at bekæmpe dødelige vira. Et nyligt internationalt samarbejde ledet af Københavns Universitet har kastet lys over de mest gådefulde CRISPR-Cas-systemer; type IV systemet. Selvom disse atypiske systemer ikke skærer gener, er deres unikke funktioner lovende i vores kamp mod antibiotikaresistens.
CRISPR-Cas-systemer er bakterielle adaptive immunsystemer, der målretter og skærer nukleinsyrerne (DNA/RNA) fra invaderende genetiske parasitter som bakteriofager (fager); vira, der inficerer - og til sidst dræber - bakterieceller. De består af to hovedkomponenter; CRISPR-arrayet, som gemmer immunhukommelsen om tidligere virusinfektioner, og cas-generne (der koder for Cas-proteiner), der er ansvarlige for at koordinere de forskellige stadier af immunresponset.
Der er i øjeblikket seks kendte typer af CRISPR-Cas-systemer, klassificeret efter deres proteinsammensætning. Alle typer, undtagen type IV, inkluderer nukleaser til DNA/RNA-spaltning.
CRISPR-Cas-systemer har vundet popularitet som genredigeringsværktøjer, hvilket giver mulighed for præcise programmerbare udskæringer på specifikke genomiske placeringer – hvilket i sidste ende fører til, at 2020 Nobelprisen i kemi tildeles for udviklingen af denne teknologi.
Løser mysteriet med de manglende komponenter
"Type IV-systemer er de mærkelige fætre blandt CRISPR-Cas-systemer, da de mangler immunhukommelsesopsamlingsmodulet og DNA-skærende komponent, der har gjort CRISPR-Cas-systemer så berømte. Disse egenskaber og deres strenge tilknytning til mobile cirkulære DNA-molekyler, kaldet plasmider, motiverede os til at påtage os opgaven med at løse deres spændende rolle og underliggende molekylære funktioner," forklarer Fabienne Benz, postdoc ved Københavns Universitet og medførsteforfatter til en undersøgelse om dette emne offentliggjort i Cell Host &Microbe .
Da kendetegnende for CRISPR-Cas er deres evne til at skære DNA på specifikke steder, fungerer Type IV-systemerne på en helt anden måde. De mangler den typiske nuklease-"saks", men rummer i stedet en DinG-helikase - et mystisk protein, der afvikler DNA.
"Vendepunktet i denne undersøgelse kom, da vi indså, at type IV-systemer ikke skærer DNA. I stedet fandt vi ud af, at de dæmper genekspression på deres målplaceringer. Dette er en unik funktionalitet, der kunne have vigtige bioteknologiske anvendelser," siger Rafael Pinilla -Redondo, adjunkt ved Biologisk Institut, og hovedforskningskoordinator for undersøgelsen.
Forskerne nåede endnu et gennembrud, da de løste, hvordan disse systemer kan fungere uden de nødvendige komponenter til at skabe immunhukommelse.
"Type IV-systemer kan omgå deres mangel på et hukommelsesopsamlingsmodul ved at kapre kompatible moduler fra andre CRISPR-Cas-systemer, der findes i værtsbakterien. Dette er fascinerende, fordi disse andre systemer kun er fjernt beslægtede," forklarer Sarah Camara-Wilpert, co- første forfatter til denne undersøgelse.
Lovende CRISPR-værktøj til at bekæmpe superbugs
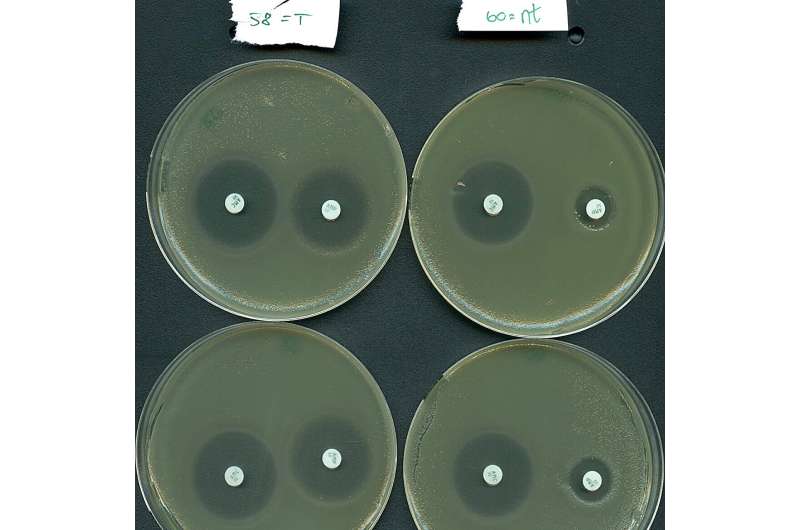
Men hvad handler al hypen om? Nå, det viser sig, at Type IV-systemer har en markant tendens til naturligt at målrette mod plasmider i stedet for bakterielle vira. Det er vigtigt, at de målrettede plasmider ofte rummer flere antibiotikaresistensgener som dem, der findes i superbugs på hospitaler. Antimikrobiel resistens anslås at være direkte ansvarlig for over 1 million dødsfald årligt på grund af behandlingssvigt.
Inspireret af deres naturlige plasmid-målretningsfunktion omprogrammerede forskerholdene effektivt et type IV-system til selektivt at dæmpe resistensgener båret af en højrisikobakterie fra indlagte patienter.
"Vores resultater tyder på, at Type IV-systemerne rummer potentiale som et nyt middel til at bekæmpe antibiotikaresistens, da vi var i stand til at re-sensibilisere et vigtigt patogen til antibiotikabehandling," siger professor Søren Sørensen, med-sidste forfatter til undersøgelsen.
Denne undersøgelse var en større tværfaglig indsats, der involverede syv internationale forskergrupper fra forskellige lande. Mens projektet startede som et samarbejde mellem kun to grupper, tog det gradvist fart og tiltrak partnere med forskellig ekspertise.
"Vi oplevede en vidunderlig sneboldeffekt, hvor hver ny partner forstærkede virkningen af arbejdet ved at dele deres unikke færdigheder og give afgørende indsigt til at løse mysterierne omkring type IV-systemer. Det har været et samarbejdende tour-de-force, præcis hvordan videnskaben burde være," bemærker Pinilla-Redondo.
Flere oplysninger: Fabienne Benz et al., Type IV-A3 CRISPR-Cas-systemer driver inter-plasmidkonflikter ved at erhverve spacere i trans, Cell Host &Microbe (2024). DOI:10.1016/j.chom.2024.04.016
Journaloplysninger: Cellevært og mikrobe
Leveret af Københavns Universitet
 Varme artikler
Varme artikler
-
 Knotty problemer i DNANår E. coli-bakterier deler sig, de skal adskille to forbundne cirkler af DNA i to separate cirkler. UC Davis-matematiker Mariel Vazquez og kolleger bruger matematikken i former (topologi) og computer
Knotty problemer i DNANår E. coli-bakterier deler sig, de skal adskille to forbundne cirkler af DNA i to separate cirkler. UC Davis-matematiker Mariel Vazquez og kolleger bruger matematikken i former (topologi) og computer -
 Bange for edderkopper? Det kan være i dit DNAKredit:Shutterstock Hypodermiske nåle, stuefluer:både potentielt truende eller frastødende, men ingen af dem fremkalder samme respons hos forsøgspersonerne i et nyligt eksperiment. Tarmreaktione
Bange for edderkopper? Det kan være i dit DNAKredit:Shutterstock Hypodermiske nåle, stuefluer:både potentielt truende eller frastødende, men ingen af dem fremkalder samme respons hos forsøgspersonerne i et nyligt eksperiment. Tarmreaktione -
 DNA-beviser sætter næsehornkrybskytter bag tremmer, viser undersøgelseNæsehorn. Kredit:Cindy Harper, D.V.M.Veterinary Genetics Laboratory University of Pretoria I mordefterforskningen, DNA-beviser hjælper ofte med at knytte en gerningsmand til et gerningssted og sæt
DNA-beviser sætter næsehornkrybskytter bag tremmer, viser undersøgelseNæsehorn. Kredit:Cindy Harper, D.V.M.Veterinary Genetics Laboratory University of Pretoria I mordefterforskningen, DNA-beviser hjælper ofte med at knytte en gerningsmand til et gerningssted og sæt -
 Koalaen:Når det er smart at være langsomKoalaer bliver ofte betragtet som søde, men dumme. Kredit:Danielle Clode Koalaen klamrede sig til en gammel træhjort, mens den strandede i Murray-floden på grænsen mellem New South Wales og Victori
Koalaen:Når det er smart at være langsomKoalaer bliver ofte betragtet som søde, men dumme. Kredit:Danielle Clode Koalaen klamrede sig til en gammel træhjort, mens den strandede i Murray-floden på grænsen mellem New South Wales og Victori
- Aliens kan være mere som os, end vi tror
- En billig organisk dampgenerator til at rense vand
- NASAs mission til Jupiters Trojanere givet grønt lys for udvikling
- Forskere identificerer nye forbindelser til behandling af RSV, Zika virus
- Kina flytter raket på plads til den kommende Mars-mission
- Flydende stråler bryder lettere op på et substrat


