Opvarmning af proteiner til kropstemperatur afslører nye lægemiddelmål
Nogle proteiner ændrer deres form, når de udsættes for forskellige temperaturer, hvilket afslører hidtil ukendte bindingssteder for medicin, har ny forskning fundet.
Resultaterne, offentliggjort i Nature , kunne revolutionere store dele af biologien ved fundamentalt at ændre, hvordan proteinstruktur studeres og udnyttes til lægemiddeldesign. Undersøgelsen blev ledet af Van Andel Institutes Juan Du, Ph.D., og Wei Lü, Ph.D.
Proteiner undersøges generelt ved lave temperaturer for at sikre deres stabilitet. Den nye undersøgelse viser dog, at visse proteiner er meget følsomme over for temperatur og ændrer deres form, når de ses ved kropstemperatur.
"I lang tid kræver de metoder, vi har brugt til at studere proteiner, at de er kolde eller frosne. Men i den virkelige verden eksisterer menneskelige proteiner og fungerer ved kropstemperatur," sagde Du. "Vores undersøgelse beskriver en ny måde at studere proteiner ved kropstemperatur på og afslører, at nogle proteiner drastisk ændrer deres strukturer, når de er varme, hvilket åbner op for nye muligheder for strukturstyret lægemiddeludvikling."
Proteiner er kroppens molekylære arbejdsheste. Deres form styrer, hvordan de interagerer med andre molekyler for at udføre deres arbejde. Ved at bestemme proteinstrukturen kan videnskabsmænd skabe tegninger, der guider udviklingen af mere effektive lægemidler, ligesom låsesmede designer nøgler, så de passer ind i specifikke låse.
Selvom det er velkendt, at temperatur påvirker molekylær funktion i kroppen, har det været teknologisk udfordrende at studere proteiner ved fysiologisk temperatur. Undersøgelsen fra Du og Lü laboratorierne beskriver, hvordan de overvandt disse problemer, og giver videnskabsfolk en køreplan for at gøre det i deres egne eksperimenter.
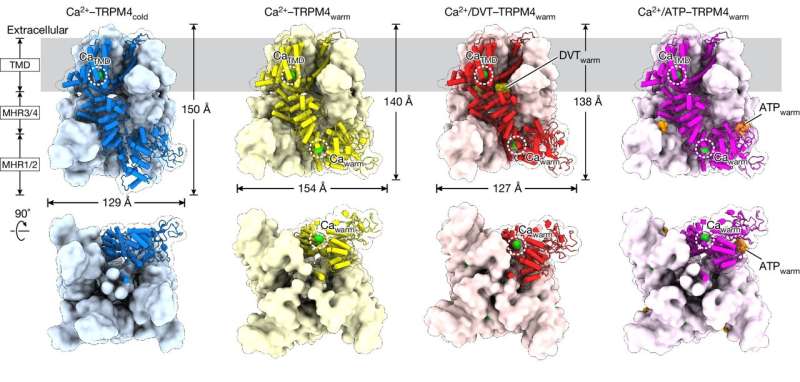
Undersøgelsen fokuserede på et protein kaldet TRPM4, som understøtter hjertefunktion og stofskifte, herunder frigivelse af insulin. Som sådan er TRPM4 blandt andet forbundet med slagtilfælde, hjertesygdomme og diabetes.
For at visualisere TRPM4 ved kropstemperatur udnyttede holdet VAI's kraftfulde pakke af kryo-elektronmikroskoper (cryo-EM), som gør det muligt for forskere at flash-fryse proteiner og samle detaljerede billeder af deres strukturer. I stedet for at bruge en lavtemperaturprøve opvarmede postdoktor Jinhong Hu, Ph.D., og kolleger i Du og Lü laboratorierne prøven til kropstemperatur, før den blev lynfryst. Ved at gøre det fandt de ud af, at ligander - molekyler, der binder til proteiner - interagerer med helt andre steder på TRPM4 ved kropstemperatur end ved lavere temperaturer.
Implikationerne af dagens undersøgelse er vidtrækkende og forstærker vigtigheden af at studere proteiner ved kropstemperatur for at sikre identifikation af fysiologisk relevante lægemiddelbindingssteder.
Andre forfattere omfatter Sung Jin Park, Ph.D., Tyler Walter, Ph.D., Ian J. Orozco, Ph.D., Garrett O'Dea og Xinyu Ye fra VAI. Cryo-EM-dataene blev indsamlet ved VAI's Cryo-EM Core og David Van Andel Cryo-Electron Microscopy Suite.
Flere oplysninger: Jinhong Hu et al., Fysiologisk temperatur driver TRPM4-ligandgenkendelse og gating, Nature (2024). DOI:10.1038/s41586-024-07436-7
Journaloplysninger: Natur
Leveret af Van Andel Research Institute
 Varme artikler
Varme artikler
-
 God hund eller dårlig hund? Ny undersøgelse viser, at racen ikke rigtig er en prædiktor for adfæ…Kredit:CC0 Public Domain En ny genetisk undersøgelse, der involverer mere end 2.000 hunde og 200.000 undersøgelsessvar fra hundeejere, har afsløret, at en hunds race er en dårlig forudsigelse af ad
God hund eller dårlig hund? Ny undersøgelse viser, at racen ikke rigtig er en prædiktor for adfæ…Kredit:CC0 Public Domain En ny genetisk undersøgelse, der involverer mere end 2.000 hunde og 200.000 undersøgelsessvar fra hundeejere, har afsløret, at en hunds race er en dårlig forudsigelse af ad -
 Hvorfor krydsede elefanten vejen? I Malaysia, de forsøger at finde svaretKredit:University of Nottingham Kroppen af en elefantkalv ligger på siden af en fjerntliggende motorvej i den nordlige del af Peninsular Malaysia-øst-vest motorvejen flankeres af to tilflugtss
Hvorfor krydsede elefanten vejen? I Malaysia, de forsøger at finde svaretKredit:University of Nottingham Kroppen af en elefantkalv ligger på siden af en fjerntliggende motorvej i den nordlige del af Peninsular Malaysia-øst-vest motorvejen flankeres af to tilflugtss -
 Når citroner giver dig liv:Herpetofauna-tilpasning til citrusplantager i BelizeOverskyet snegleædende slange ( Sibon nebulatus ) i et lindetræ, Stann Creek, Belize. Kredit:Russell Gray Naturlige habitatområder udviser lignende overflod og mangfoldighed af herpetofauna som
Når citroner giver dig liv:Herpetofauna-tilpasning til citrusplantager i BelizeOverskyet snegleædende slange ( Sibon nebulatus ) i et lindetræ, Stann Creek, Belize. Kredit:Russell Gray Naturlige habitatområder udviser lignende overflod og mangfoldighed af herpetofauna som -
 Hvorfor opretstående pingviner afviser deres første æg og lægger et andetOpretstående pingviner er kendetegnet ved de slående opretstående toppe af gule fjer over deres øjne. Kredit:Lloyd Davis Photography (lloyddavis.com), CC-BY 4.0 (creativecommons.org/licenses/by/4.0/)
Hvorfor opretstående pingviner afviser deres første æg og lægger et andetOpretstående pingviner er kendetegnet ved de slående opretstående toppe af gule fjer over deres øjne. Kredit:Lloyd Davis Photography (lloyddavis.com), CC-BY 4.0 (creativecommons.org/licenses/by/4.0/)
- Spotify vinder flere fans i aktiemarkedsdebuten, efterhånden som aktierne stiger
- Kan tisse hjælpe med at brødføde verden?
- Hackere? Ingen, menneskelige fejl plager den primære afstemning i Arizona
- Trin-for-trin videnskabsprojekt, hvori juice rengøres penge Best
- Brug en chip til at finde bedre kræftbekæmpende lægemidler
- Hvad er undergrupper med reelle tal?


