Forskere studerer forviklingerne ved homolog rekombination og unormale kromosombroer
At holde den genetiske information lagret i genomisk DNA intakt under celledelingscyklussen er afgørende for næsten alle livsformer. Omfattende DNA-skader forårsager uvægerligt forskellige uønskede genomiske omlejringer, som kan føre til celledød i de bedste tilfælde og til forekomsten af sygdomme som kræft i de værste tilfælde.
Heldigvis deler celler i alle tre livsdomæner en ejendommelig fejlfri mekanisme til opretholdelse af genetisk information, kendt som homolog rekombination (HR).
HR-processen starter, når en celle støder på DNA-beskadigelse under DNA-syntese eller bagefter, og initierer en kaskade af begivenheder. Det beskadigede DNA resekeres eller skæres først for at skabe enkeltstrengede ender nær det beskadigede sted. Disse ender matches derefter til deres tilsvarende region i et tilgængeligt replikeret kromosom, også kendt som "søsterkromatid", som i det væsentlige bruges som skabelon til at reparere det beskadigede DNA.
Som man kunne forvente, involverer HR-vejen et utal af proteiner og cellulært maskineri. Mens de fleste af disse proteiner og cellulære maskineri er velundersøgte, forbliver nogle af dem noget gådefulde. Sådan er det med regulatorerne af RAD51, et protein, der er ansvarligt for at reparere DNA-dobbeltstrengsbrud.
Normalt danner RAD51 filamenter, der hjælper med at bevare DNA-replikationsgafler - forbigående arrangementer af DNA, der ofte forekommer under DNA-replikation, såsom i replikationsgaffelsammenbrud. Korrekt regulering af RAD51, såvel som nedbrydningen af disse filamenter, efter deres formål er blevet tjent, er afgørende for HR.
Imidlertid er de præcise mekanismer, hvorved unormal RAD51-akkumulering fører til genetisk ustabilitet, ikke fuldstændigt forstået, og mange positive og negative RAD51-regulatorer forbliver uklare.
Men nu i en nylig artikel offentliggjort i Nucleic Acid Research den 10. april 2024 undersøgte et forskerhold ledet af professor Miki Shiinoara fra Institut for Avanceret Biovidenskab, Kindai University, Japan, det tætte forhold mellem RAD51 og FIGNL1, en af dets vigtigste regulatorer. Undersøgelsen var medforfatter af Kenichiro Matsuzaki, også fra Department of Advanced Bioscience, Kindai University, og kaster noget tiltrængt lys over HR-processens forviklinger.
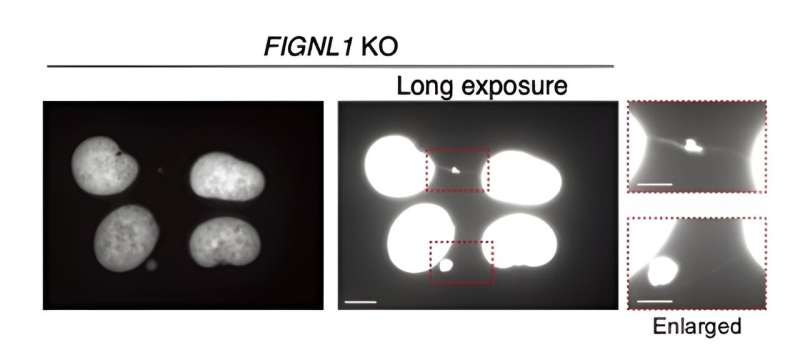
Først gensplejsede forskerne menneskelige celler, der ikke udtrykte FIGNL1 (det vil sige FIGNL1 KO-celler), ved hjælp af den veletablerede CRISPR/Cas9-metode. Ved hjælp af avancerede immunfarvningsteknikker, der involverer omhyggeligt udvalgte antistoffer og fluorescensmikroskopi, visualiserede de HR-processen i detaljer og ledte efter indikatorer for abnormiteter.
Ved at kombinere denne tilgang med et væld af andre eksperimentelle procedurer, såsom western blotting, cellecyklusanalyse, proteinassays og genomiske og transkriptomiske analyser, lykkedes det dem at få et omfattende billede af, hvad der sker i en celle, når FIGNL1 mangler.
Resultaterne afslører, at FIGNL1 er et højt specialiseret RAD51-demonteringsenzym, der er nødvendigt for korrekt kromosomadskillelse, efter at replikationsgaflerne er "skilt ad."
Mere specifikt, når RAD51-filamenter ikke er fuldstændig demonteret, opstår der unormale hændelser under mitose, der producerer uopløste mellemprodukter. Dette fører i sidste ende til dannelsen af såkaldte 'kromosombroer' mellem søsterkromatiderne. Disse ultrafine strukturer er meget skadelige for cellens normale drift, hvilket forårsager udbredelsen af katastrofal genetisk information.
At forstå de finere detaljer i HR-forløbet, dets nøglespillere og dets mange delprocesser er ekstremt vigtigt, ikke kun fra et biologisk perspektiv, men også fra et medicinsk synspunkt.
"Celledød på grund af dysregulering af HR er en vigtig mekanisme, hvormed anticancer-lægemidler udviser cancercellespecifik cytotoksicitet," forklarer prof. Shinohara. "Indtil nu har hovedmålet været HR-aktiveringsmangel, men resultaterne af denne undersøgelse viser, at vedvarende aktivering af RAD51 også udviser cytotoksicitet og kan være et molekylært mål for lægemidler mod kræft."
Desuden kan det cellulære maskineri, der er involveret i HR-forløbet, udnyttes som et kraftfuldt bioingeniørværktøj.
"HR er et velbevaret system blandt de fleste arter og er også tæt forbundet med genmodifikationsteknologier, såsom genomredigering og genmålretningsteknologier," kommenterer Prof. Shinohara, "Således belyser de mekanismer, der kontrollerer rekombinaseaktivitet, som f.eks. af RAD51, kan bidrage til at øge effektiviteten af genmodifikationsteknikker."
Værd at bemærke, genteknologi er en yderst effektiv vej til at øge afgrødeudbyttet og til at tilpasse mikrobielle organismer til opgaver som bioremediering, som adresserer forskellige moderne verdensproblemer.
Samlet set kaster resultaterne af denne undersøgelse ikke kun lys over en universel biologisk proces, men baner også vejen mod en bedre forståelse af cellulære mekanismer for vigtige lægemiddelopdagelser og fremskridt inden for genteknologi.
Flere oplysninger: Kenichiro Matsuzaki et al., Human AAA+ ATPase FIGNL1 undertrykker RAD51-medieret ultrafin brodannelse, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae263
Journaloplysninger: Nukleinsyreforskning , Nukleinsyreforskning
Leveret af Kindai University
 Varme artikler
Varme artikler
-
 Påmindelse:Kænguruer er vegetariske gladiatorer med spark, der kan dræbe. En ekspert forklarer, h…Kænguruer er i bund og grund fredselskende planteædere, men vil angribe, hvis de bliver stødt eller provokeret. Kredit:Shutterstock Kænguruer kan være farlige. I denne uge døde en 77-årig mand trag
Påmindelse:Kænguruer er vegetariske gladiatorer med spark, der kan dræbe. En ekspert forklarer, h…Kænguruer er i bund og grund fredselskende planteædere, men vil angribe, hvis de bliver stødt eller provokeret. Kredit:Shutterstock Kænguruer kan være farlige. I denne uge døde en 77-årig mand trag -
 Parasitter og værter reagerer muligvis forskelligt på en varmere verdenAlyssa Gehman fandt ud af, at organismer inficeret med parasitter kan være mere følsomme over for ændringer i temperaturen. Kredit:University of Georgia Organismer, der er inficeret af parasitter,
Parasitter og værter reagerer muligvis forskelligt på en varmere verdenAlyssa Gehman fandt ud af, at organismer inficeret med parasitter kan være mere følsomme over for ændringer i temperaturen. Kredit:University of Georgia Organismer, der er inficeret af parasitter, -
 Sådan gør man tang-akvakultur til en bedre kulstofdrænUMaine Marine Science-studerende Cole Roxbury med tang på Darling Marine Center. Kredit:Adam St. Gelais. Omkostningseffektive teknologier til fjernelse af kuldioxid spiller en nøglerolle i bekæmpel
Sådan gør man tang-akvakultur til en bedre kulstofdrænUMaine Marine Science-studerende Cole Roxbury med tang på Darling Marine Center. Kredit:Adam St. Gelais. Omkostningseffektive teknologier til fjernelse af kuldioxid spiller en nøglerolle i bekæmpel -
 Hvordan celler retter fejl under tidspresEn gærcelle racer mod et stop. Kredit:Nguyen Tâm Johan (EPFL) Hvordan risikerer en cellebalance og hastighed ved opdeling? EPFL-forskere har udviklet og eksperimentelt testet den første matematiske
Hvordan celler retter fejl under tidspresEn gærcelle racer mod et stop. Kredit:Nguyen Tâm Johan (EPFL) Hvordan risikerer en cellebalance og hastighed ved opdeling? EPFL-forskere har udviklet og eksperimentelt testet den første matematiske
- Hvordan skadedyrsbekæmpelsesstrategier påvirker bundlinjen
- Ikke mere sød tand? Videnskaben slukker sukkertrang hos mus
- Laser producerer infrarøde stråler over et hidtil uset område af bølgelængder
- Overmodige administrerende direktører er mere tilbøjelige til at blive sagsøgt
- Hvordan en enorm skov af uddøde træer udløste transformation af livet på Jorden
- Ikke-lineære effekter i koblede optiske mikrokaviteter


