Test af, hvor godt biomarkører virker:Ny fluorescensmikroskopimetode kan forbedre opløsning ned til Ångström-skalaen
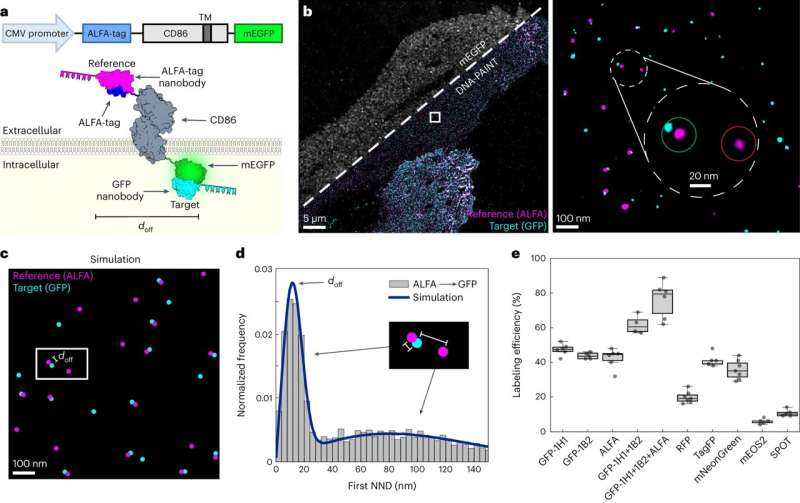
LMU-forskere har udviklet en metode til at bestemme, hvor pålideligt målproteiner kan mærkes ved hjælp af superopløsningsfluorescensmikroskopi.
Moderne mikroskopiteknikker gør det muligt at undersøge cellers indre funktion i forbløffende detaljer. "Vi kan nu observere arrangementet og interaktionen af individuelle proteiner under mikroskopet," siger professor Ralf Jungmann, formand for Molecular Physics of Life ved LMU og Max Planck Fellow ved MPI of Biochemistry.
Biofysikerens team udviklede for nylig den revolutionerende RESI (Resolution Enhancement by Sequential Imaging) metode. Denne teknik kan bruges til at forbedre opløsningen af fluorescensmikroskopi ned til Ångström-skalaen - langt under den klassiske diffraktionsgrænse for lys. DNA-konjugerede markørmolekyler, som forskerne knytter præcist til de molekyler, de gerne vil forstå bedre, er afgørende for dette.
Jungmanns team har nu præsenteret en teknik i tidsskriftet Nature Methods der kan bruges til at kvantificere, hvor godt biomarkørmolekyler binder til målproteinerne. "Dette er helt afgørende, hvis du vil lave kvantitativt pålidelige udsagn," forklarer fysikeren.
Hvis du kender mærkningseffektiviteten, kan du udføre rumligt opløst proteomik på denne måde. Dette giver dig mulighed for at finde ud af ikke kun, hvad individuelle proteiner gør i en celle, men også i hvilket omfang de er til stede, og hvordan deres mængde og adfærd ændrer sig under visse omstændigheder. "Men det er kun muligt, hvis vi kan vurdere, hvor godt mærkningen har fungeret." Dette skyldes, at kun mærkede proteiner udsender lysglimt under mikroskopet og dermed bliver synlige.
Metoden udviklet af Jungmanns team gør denne vurdering mulig ved at tilføje en referencebiomarkør til målproteinerne. Denne markør "gløder" i en anden farve under mikroskopi, så vellykkede markerede proteiner vises i to farver.
Jungmanns team demonstrerede dette ved hjælp af blandt andet membranproteinet CD86:Referencen producerer en lyserød fluorescens, selve markøren en blålig. Dette skaber et mønster af utallige lyserøde og blå lyspunkter. Hvor mærkningen ikke virkede, lyser kun referencen individuelt. Markeringseffektiviteten beregnes ud fra forholdet mellem dobbelt- og enkeltbelyste molekyler.
Metoden giver flere fordele sammenlignet med tidligere metoder til bestemmelse af bindingseffektivitet, "Den virker ikke kun in vitro, men også in vivo, dvs. i sammenhæng med intakte celler," forklarer Jungmann. "Teknikken kan også anvendes på en række forskellige målmolekyler, biomarkører og prøver og er kompatibel med en lang række superopløsningsmetoder."
Et pålideligt og bredt anvendeligt middel til at vurdere markøreffektivitet er afgørende for at sikre nøjagtig dataevaluering og muliggøre pålidelige sammenligninger mellem forskellige bindemidler, mærkningsbetingelser og forskningslaboratorier.
Forfatterne til undersøgelsen er sikre på, at den nye kvantificeringsmetode har banet vejen for markant at udvide potentialet i deres superopløsningsmikroskopmetode, "Nu kan vi også overveje specifikke biomedicinske applikationer, hvor den kvantitative påvisning af proteiner og processer er af stor betydning. betydning," siger Jungmann.
Dette omfatter for eksempel kræftforskning, hvor information om interaktioner mellem proteiner på celleoverfladen og lægemidler med molekylær opløsning er afgørende for udviklingen af nye typer medicin.
Flere oplysninger: Joschka Hellmeier et al., Kvantificering af absolut mærkningseffektivitet på enkeltproteinniveau, Naturmetoder (2024). DOI:10.1038/s41592-024-02242-5
Journaloplysninger: Naturmetoder
Leveret af Ludwig Maximilian University of München
 Varme artikler
Varme artikler
-
 Seks nylige opdagelser, der har ændret, hvordan vi tænker om menneskelig oprindelseNeandertaler voksen mand, baseret på 40.000 år gamle rester fundet hos Spy i Belgien. Kredit:IR Stone/Shutterstock Videnskabelige studier af menneskelig evolution forsikrede os historisk om en trøs
Seks nylige opdagelser, der har ændret, hvordan vi tænker om menneskelig oprindelseNeandertaler voksen mand, baseret på 40.000 år gamle rester fundet hos Spy i Belgien. Kredit:IR Stone/Shutterstock Videnskabelige studier af menneskelig evolution forsikrede os historisk om en trøs -
 Matematik gør det muligt for videnskabsmænd at forstå organisationen i en cellekerneKlasser af transkriptionsklynger. I en selvbærende transkriptionsklynge er en TF og genet, der koder for den TF, begge til stede. De inter- og intrakromosomale eksempler i henholdsvis (a) og (b) illus
Matematik gør det muligt for videnskabsmænd at forstå organisationen i en cellekerneKlasser af transkriptionsklynger. I en selvbærende transkriptionsklynge er en TF og genet, der koder for den TF, begge til stede. De inter- og intrakromosomale eksempler i henholdsvis (a) og (b) illus -
 Forskere præsenterer en ny metode til direkte og hurtigt at ødelægge ethvert protein i enhver for…Trim-Away ødelægger direkte og hurtigt et fluorescerende protein (blåt) i en ægcelle. Billederne viser cellen før introduktion af antistoffer rettet mod proteinet og 10, 30, og 60 minutter derefter (f
Forskere præsenterer en ny metode til direkte og hurtigt at ødelægge ethvert protein i enhver for…Trim-Away ødelægger direkte og hurtigt et fluorescerende protein (blåt) i en ægcelle. Billederne viser cellen før introduktion af antistoffer rettet mod proteinet og 10, 30, og 60 minutter derefter (f -
 Mysteriet om uddøde newzealandske fisk optrevletDr. Nic Rawlence og professor Gerard Closs med et upokororo/New Zealand harreksemplar på Otago Museum. Kredit:University of Otago Næsten 100 år efter dets sidste bekræftede observation, har forsker
Mysteriet om uddøde newzealandske fisk optrevletDr. Nic Rawlence og professor Gerard Closs med et upokororo/New Zealand harreksemplar på Otago Museum. Kredit:University of Otago Næsten 100 år efter dets sidste bekræftede observation, har forsker
- Majsgenetik giver indsigt i de afgrøder, der er historiske spredt over hele Amerika
- Forskere belyser substratgenkendelse og protonkoblingsmekanisme for transporterprotein VMAT2
- Sådan finder du radien af en delvis cirkel
- Grafen-baseret nanomat kan føre til næste generations katalysatorer
- Øget hyppighed af forbundne mønstre fra tørke til kraftig regn i regionale hotspots
- En snurrende komet observeres hurtigt at sænke farten under tæt tilnærmelse til Jorden


